Cho luồng khí N2O5 dư sục vào a (g) hh bột gồm K2O và MgO thì sau khi pư xảy ra hoàn toàn thu được a+21,6 g chất rắn
Nếu cho a(g) hh bột rắn trên tác dụng với 1200 ml dd HCl 1M thì pư xảy ra vừa đủ.
a) Tính thể tích (đktc) N2O5 đã pư?
b) Tính a
Bt2. Hòa tan 6,45 g hh bột X gồm Al và Mg vào 200ml dd chứa CuSO4 1M và FeSO4 1M. Sau khi các phản ứng xảy ra hoàn toàn thu đc dd Y gồm ba muối và m gam chất rắn Z. Cho Y tác dụng với lượng dư dd Ba(OH)2, sau khi kết thúc các pư thu đc 105,75 gam chất kết tủa .
a. Tính phần trăm khối lượng mỗi kl trong X
b. Tính m
cho 18,6 g hh A gồm Zn và Fe vào dd chứa 0,5a mol HCl. Khi PƯ xảy ra hoàn toàn, cô cạn dd thu được 34,575 g chất rắn. Lập lại thí nghiệm trên với dd chứa a mol HCl rồi cô cạn thì thu được 39,9 g chất rắn. Tính a và khối lượng mỗi kim loại trong 18,6 g hh A
Do ở TN2, khi tăng lượng HCl, khối lượng rắn tăng thêm
=> Trong TN1, HCl hết, kim loại dư
- Xét TN1
Theo ĐLBTKL: mA + mHCl = mrắn sau pư + mH2
=> 18,6 + 36,5.0,5a = 34,575 + 2.0,25a
=> a = 0,9
- Xét TN2:
Giả sử HCl hết
Theo ĐLBTKL: 18,6 + 0,9.36,5 = 39,9 + 0,45.2
=> 51,45 = 40,8 (vô lí)
=> HCl dư, kim loại hết
Gọi số mol Zn, Fe là a, b
=> 65a + 56b = 18,6
PTHH: Zn + 2HCl --> ZnCl2 + H2
a--------------->a
Fe + 2HCl --> FeCl2 + H2
b---------------->b
=> 136a + 127b = 39,9
=> a = 0,2 ; b = 0,1
=> \(\left\{{}\begin{matrix}m_{Zn}=0,2.65=13\left(g\right)\\m_{Fe}=0,1.56=5,6\left(g\right)\end{matrix}\right.\)
Hoà tan hh gồm: K2O, BaO, A12O3, Fe3O4 vào nước (dư), thu được dd X và chẩt rắn Y. Sục khí CO2 đến dư vào dd X, sau khi các pư xảy ra hoàn toàn thu được kết tủa là
A. Fe(OH)3.
B. K2CO3.
C. Al(OH)3.
D. BaCO3.
Đáp án C
Các phương trình phản ứng:
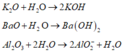
Rắn Y là Fe3O4 và có thể A12O3 dư. Dung dịch X có chứa A l O 2 -
![]()
Nung nóng m gam hh gồm A1 và Fe3O4 trong điều kiện không có không khí. Sau khi pư xảy ra hoàn toàn, thu được hh rắn X. Cho X t/d với dd NaOH (dư) thu được dd Y, chất rắn Z và 3,36 lít khí H2 (ở đktc). Sục khí CO2 (dư) vào dd Y, thu được 39 gam kết tủa. Giá trị của m là
A. 45,6.
B. 48,3.
C. 36,7.
D. 57,0.
Đáp án B
Rắn X phải có A1 dư vì chỉ có A1 mới phản ứng với dung dịch NaOH tạo khí H2. Mặt khác do phản ứng hoàn toàn nên Fe3O4 hết.
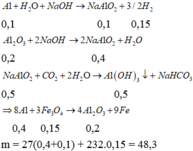
Có 135.6g hỗn hợp A gồm Ag và Cu. Chia hh ra thành ba phần A1,A2, A3
Cho A1 tác dụng với Oxi thu được 48.4 g hh rắn (B) và thấy khối lượng sản phẩm tăng 3.2 so với A1. Tính khối lượng A1
đốt nóng hoàn toàn A2 rồi đưa vào bình đựng khí Clo thì thấy đã dùng V ml Cl2 và 35.025g (C) (C chỉ toàn là muối).Tính kl từng chất trong A2 và tính V.
trộn thêm một lượng bột nhôm vào A3 thì thu được hh rắn (D) (không xảy ra pư khi trộn nhôm vào A3). Nhỏ hết dd axit clohiđric vào hh (D) thu được dd (E), chất rắn (F) (trong (F) vẫn còn nhôm) và 6.72 lít hiđro (đktc). Biết lượng nhôm còn dư 10% so với luợng cần thiết. Tính khối lượng % từng chất có trong hh (F)
Giải dùm mình bài này gấp nha, mình đang cần dữ lắm :'(
2CuO+O2--->2CuO.
ma1 tăng=mO2= 3,2g -->nO2=0,1
-->nCu=nCuO=0,2 .mcu=12,8 g
mcuo=16g --> mAg=48,4 -16=32,4g
ma1=45,2g -->nAg:nCu=3:2
Gọi ncu=2x-->nAg=3x. Theo phản ứng của cu,Ag vs cl2 --> ncucl2=2x; nAgcl=3x. mc=700,5x=35,025.
->x=0,05 ->…->mcu=6,4g; mAg=16,2g
->ma2=22,6g ->ma3=67,8g
2Al+6HCl-->2AlCl3+3H2
nAl=2/3 nH2=0,2 -> nAl dư=0,02 ->mF=68,34g ->%Al=3,16%,
% Cu=28.09%,%Al=68,75%
hh A gồm các chất BaO, CuO, Fe3O4 và Al2O3 (có số mol bằng nhau). Dẫn luồng khí CO dư qua m (g) hh A nung nóng, pư kết thúc thu được chất rắn B và hh khí C. Cho B vào nước dư thu được dd X và phần không tan Y. Sục khí C vào dd X thu được a (g) kết tủa. Cho Y vào 225m/71 (g) AgNO3, thu được 250g dd Z và 59,4g kim loại. Biết các pư đều xảy ra hoàn toàn.
Tính a và nồng độ phần trăm các chất trong dd Z
Câu 2
1. Dẫn khí CO dư đi qua 52,2 g hh gồm Fe2O3, MgO, ZnO nung nóng. Đợi pư hoàn toàn thu được chất rắn A , hh khí B. để hòa tan hết chất rắn A cần tới 500ml dd HCl 3,2M và thấy sinh ra 12 lit khí ở đk thường.
Tính thành phần % theo khối lượng mỗi chất trong hh ban đầu
2. Hòa tan hoàn toàn 31,3g hh gồm K và Ba vào nước, thu được dd X và 5,6lit khí ở đktc. Sục 8,96lit khí CO2 vào dd X, thu được m gam kết tủa.
a/ Tính khối lượng mỗi chất trong hh ban đầu.
b/ Tính giá trị m.
Câu 3
Hòa tan hoàn toàn 12g hh gồm Ag, Mg, Al bằng một lượng vừa đủ dd H2SO4 thu được 4,48 lit SO2 duy nhất ở đktc và m g muối rắn khan.
a/ Tính giá trị m.
b/ Dẫn từ từ lượng khí trên vào 200g dd NaOH thì thu được dd A có nồng độ muối axit là
Câu 4:
1. Biết khi đốt cháy hết 24 g hỗn hợp gồm 3 kim loại thì thu được 32,16g oxit.
Tính thể tích khí thu được khi cho 20g hh các kim loại trên tan hết trong dd HCl. Biết hóa trị các kim loại không đổi.
14,662%. Tính nồng độ % dd NaOH đã dung.
2. Cho 33,6 gam sắt vào V ml dung dịch HNO3 24% ( D dd = 1,05g/ml) loãng, sau phản ứng thu được dung dịch A và 11,2 lít khí NO duy nhất ở điều kiện tiêu chuẩn. Tính giá trị V và nồng độ mol của mỗi chất tan trong dung dịch A.
Các bạn làm ơn giúp mình mình đang cần rất gấp mình cmar ơn các bạn rất nhiều
bài 2
+) TH1 : nNaOH ≥ 2.nCO2 => OH- dư
=> nCO3 = nCO2
+) TH2 : nCO2 < nNaOH < 2.nCO2 => Sinh ra 2 muối CO32- và HCO3-
=> nCO3 = nOH – nCO2
+) TH3 : nCO2 > nNaOH => CO dư => sinh ra muối HCO3-.
=> nHCO3 = nNaOH
K + H2O -> KOH + ½ H2
Ba + 2H2O -> Ba(OH)2 + H2
=> nK.0,5 + nBa = nH2 = 0,25 mol
Và : mK + mBa = 31,3g
=> nK = 0,1 ; nBa = 0,2 mol
Vậy dung dịch X có : 0,1 mol KOH ; 0,2 mol Ba(OH)2
X + CO2 (0,4 mol)
Có : nCO2 < nOH = 0,5 mol < 2.nCO2
=> nCO3 = nOH – nCO2 = 0,1 mol < nBa2+ = 0,2 mol
Vậy kết tủa là 0,1 mol BaCO3
=> m = 19,7g
Câu 2
1. Dẫn khí CO dư đi qua 52,2 g hh gồm Fe2O3, MgO, ZnO nung nóng. Đợi pư hoàn toàn thu được chất rắn A , hh khí B. để hòa tan hết chất rắn A cần tới 500ml dd HCl 3,2M và thấy sinh ra 12 lit khí ở đk thường.
Tính thành phần % theo khối lượng mỗi chất trong hh ban đầu
2. Hòa tan hoàn toàn 31,3g hh gồm K và Ba vào nước, thu được dd X và 5,6lit khí ở đktc. Sục 8,96lit khí CO2 vào dd X, thu được m gam kết tủa.
a/ Tính khối lượng mỗi chất trong hh ban đầu.
b/ Tính giá trị m.
Câu 3
Hòa tan hoàn toàn 12g hh gồm Ag, Mg, Al bằng một lượng vừa đủ dd H2SO4 thu được 4,48 lit SO2 duy nhất ở đktc và m g muối rắn khan.
a/ Tính giá trị m.
b/ Dẫn từ từ lượng khí trên vào 200g dd NaOH thì thu được dd A có nồng độ muối axit là
Câu 4:
1. Biết khi đốt cháy hết 24 g hỗn hợp gồm 3 kim loại thì thu được 32,16g oxit.
Tính thể tích khí thu được khi cho 20g hh các kim loại trên tan hết trong dd HCl. Biết hóa trị các kim loại không đổi.
14,662%. Tính nồng độ % dd NaOH đã dung.
2. Cho 33,6 gam sắt vào V ml dung dịch HNO3 24% ( D dd = 1,05g/ml) loãng, sau phản ứng thu được dung dịch A và 11,2 lít khí NO duy nhất ở điều kiện tiêu chuẩn. Tính giá trị V và nồng độ mol của mỗi chất tan trong dung dịch A. Các bạn làm ơn giúp mình, mình đang cần rất gấp. Mình cảm ơn các bạn rất nhiều
Câu 2.2:
a,\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 2K + 2H2O → 2KOH + H2
Mol: x 0,5x
PTHH: Ba + 2H2O → Ba(OH)2 + H2
Mol: y y
Ta có: \(\left\{{}\begin{matrix}39x+137y=31,3\\0,5x+y=0,25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
\(\Rightarrow m_K=0,1.39=3,9\left(g\right);m_{Ba}=0,2.137=27,4\left(g\right)\)
bạn nên đăng 1-2 câu tự luận trong 1 lần đăng nhé
Cho 9,2 g bột x gồm Mg và Fe vào 200 ml dd CuSO4 1M. Sau phản ứng xảy ra hoàn toàn thu được dung dịch y và 15,6 g chất rắn
a) tính khối lượng mỗi kim loại trong x
b) Cho y tác dụng với lượng dư dung dịch naoh tính khối lượng kết tủa thu được khi kết thúc các phản ứng
\(Mg>Fe\) => `Mg` phản ứng trước
\(Mg+Cu^{2+}\rightarrow Mg^{2+}+Cu^o\)
x----->x-------------------->x
\(Fe+Cu^{2+}\rightarrow Fe^{2+}+Cu^o\)
y----->y----------------->y
Giả sử nếu \(Cu^{2+}\) chuyển hết thành \(Cu^o\)
\(\Rightarrow n_{Cu^o}=n_{Cu^{2+}}=n_{kt}\)
Có \(n_{Cu^{2+}}=0,2.1=0,2\left(mol\right)\)
\(n_{kt}=\dfrac{15,6}{64}=0,24375\left(mol\right)>0,2\left(mol\right)\)
\(\Rightarrow\)Giả sử sai, kim loại Fe trong hỗn hợp X còn dư
Theo đề có: \(m_{Fe.dư}=m_{kt}-m_{Cu}=15,6-0,2.64=2,8\left(g\right)\)
Ta có hệ phương trình:
\(\left\{{}\begin{matrix}24x+56y=9,2-2,8=6,4\\x+y=0,2\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}x=0,15\\y=0,05\end{matrix}\right.\)
a. Trong X có:
\(\left\{{}\begin{matrix}m_{Mg}=24.0,15=3,6\left(g\right)\\m_{Fe}=56.0,05+2,8=5,6\left(g\right)\end{matrix}\right.\)
b
Y: \(\left\{{}\begin{matrix}n_{MgSO_4}=x=0,15\left(mol\right)\\n_{FeSO_4}=y=0,05\left(mol\right)\end{matrix}\right.\)
\(MgSO_4+2NaOH\rightarrow Mg\left(OH\right)_2+Na_2SO_4\)
0,15--------------------->0,15
\(FeSO_4+2NaOH\rightarrow Fe\left(OH\right)_2+Na_2SO_4\)
0,05-------------------->0,05
\(m_{kt}=m_{Mg\left(OH\right)_2}+m_{Fe\left(OH\right)_2}=0,15.58+0,05.90=13,2\left(g\right)\)