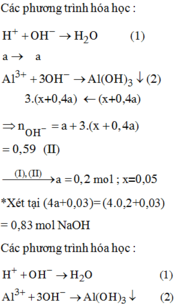Nhận biết naoh với hỗn hợp hcl và alcl3

Những câu hỏi liên quan
Cho 200 ml dung dịch hỗn hợp gồm MgCl2 0,3M, AlCl3 0,45 M và HCl 0,55M tác dụng hoàn toàn với V lít dung dịch hỗn hợp gồm NaOH 0,02M và Ba(OH)2 0,01M. Giá trị của V để được kết tủa lớn nhất và lượng kết tủa nhỏ nhất lần lượt là A. 1,25 lít và 1,475 lít B. 1,25 lít và 14,75 lít C. 12,5 lít và 14,75 lít D. 12,5 lít và 1,475 lít
Đọc tiếp
Cho 200 ml dung dịch hỗn hợp gồm MgCl2 0,3M, AlCl3 0,45 M và HCl 0,55M tác dụng hoàn toàn với V lít dung dịch hỗn hợp gồm NaOH 0,02M và Ba(OH)2 0,01M. Giá trị của V để được kết tủa lớn nhất và lượng kết tủa nhỏ nhất lần lượt là
A. 1,25 lít và 1,475 lít
B. 1,25 lít và 14,75 lít
C. 12,5 lít và 14,75 lít
D. 12,5 lít và 1,475 lít
Nhận thấy kết tủa lớn nhất khi có Mg(OH)2 : 0,06 mol và Al(OH)3 : 0,09 mol
nOH- = nH+ + 2×nMg2+ + 3×nAl3+ = 0,11 + 2×0,06 + 3×0,09 = 0,5 mol
→ 0,02V + 0,02V= 0,5 → V= 12,5 lít
Kết tủa nhỏ nhất khi chỉ có Mg(OH)2 : 0,06 mol
nOH- = nH+ + 2×nMg2+ + 4×nAl3+ = 0,11 + 2×0,06 + 4×0,09 = 0,59 mol
→ 0,02 V + 0,02V = 0,59 → V= 14,75 lit
Đáp án C
Đúng 0
Bình luận (0)
Câu 4: Bằng phương pháp hóa học hãy nhận biết các dung dịch sau
: a/ Ba(OH)2, HNO3, KNO3,HCl.
b/ HCl, NaCl, NaOH, , NaBr.
c/ NaOH, HCl, NaCl, NaNO3.
d/ CaCl2, KOH, KBr, HNO3
Câu 6: Cho 30g hỗn hợp gồm Cu và Zn tác dụng hết với 200g dung dịch HCl thu được 5600ml khí (đktc). a. Tính khối lượng mỗi kim loại. b. Tính thành phần % khối lượng mỗi kim loại. c. Tính nồng độ % HCl.
Câu 6:
\(Zn+2HCl\rightarrow ZnCl_2+H_2\\ n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\\ a,n_{Zn}=n_{H_2}=0,25\left(mol\right)\Rightarrow m_{Zn}=0,25.65=16,25\left(g\right)\\ \Rightarrow m_{Cu}=m_{hh}-m_{Zn}=30-16,25=13,75\left(g\right)\\ b,\%m_{Zn}=\dfrac{16,25}{30}.100\approx54,167\%\Rightarrow\%m_{Cu}\approx45,833\%\\ c,n_{HCl}=2.n_{H_2}=2.0,25=0,5\left(mol\right)\Rightarrow C\%_{ddHCl}=\dfrac{0,5.36,5}{200}.100=9,125\%\)
Đúng 2
Bình luận (0)
Câu 4:
a) - Thử với lượng nhỏ mỗi chất.
- Bảng nhận biết:
| dd Ba(OH)2 | dd HNO3 | dd KNO3 | dd HCl | |
| Quỳ tím | Xanh | Đỏ | Tím | Đỏ |
| dd AgNO3 | Đã nhận biết | Không hiện tượng | Đã nhận biết | Kết tủa trắng |
\(PTHH:AgNO_3+HCl\rightarrow AgCl\downarrow\left(trắng\right)+HNO_3\)
Đúng 1
Bình luận (0)
Câu 4b)
- Thử với lượng nhỏ mỗi chất.
- Bảng nhận biết:
| dd HCl | dd NaCl | dd NaOH | dd NaBr | |
| Quỳ tím | Đỏ | Tím | Xanh | Tím |
| dd AgNO3 | Đã nhận biết | Kết tủa trắng | Đã nhận biết | Kết tủa vàng nhạt |
\(PTHH:AgNO_3+NaBr\rightarrow AgBr\downarrow\left(vàng.nhạt\right)+NaNO_3\\ AgNO_3+NaCl\rightarrow AgCl\downarrow\left(trắng\right)+NaNO_3\)
Đúng 1
Bình luận (0)
Xem thêm câu trả lời
Bài 1: Viết phương tình phản ưng este, anilin, amino axit với NaOH, HCl,dung dịch Br2
Bài 2 : Nhận biết các chất amin, amino axit, axit, anilin
Bài 3: Bài tập amino axit tác dụng với NaOH, HCl
Bài 4: Bài tập hỗn hợp kim loại và hợp chất tác dụng với H2SO4 đặc nóng
(mình đag cần rất gấp ạ!!!)
Nhận biết các dd: NaOH, HCl, H2SO4, AlCl3, MgCl2 chỉ dùng phenolphtalein
NaOH sẽ khiến phenolphtalein chuyển thành màu hồng, HCl và H2SO4 sẽ khiến phenolphtalein chuyển thành không màu, còn AlCl3 và MgCl2 sẽ ko có hiện tượng gì.
Cho Ba(OH)2 vào hai lọ chứa HCl và H2SO4. Nếu có hiện tượng kết tủa thì đó là H2SO4, còn ko có hiện tượng thì là Ba(OH)2
Ta sẽ cho KOH dư vào trong hai lọ chứa AlCl3 và MgCl2. Nếu có hiện tượng kết tủa trắng và sau đó tan thì AlCl3, còn kết tủa trắng nhưng lại ko tan thì đó là MgCl2.
Đúng 0
Bình luận (1)
nêu hiện tượng giải thích và viết pthh:
a) nhỏ từ từ đến dư dd AlCl3 vào dd KOH
b) nhỏ từ từ đến dư dd HCl vào dd hỗn hợp NaOH và NaAlO2
a)
Xuất hiện kết tủa keo trắng.
\(AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3+3NaCl\)
b)
Xuất hiện kết tủa keo trắng sau đó tan dần
\(HCl+NaOH\rightarrow NaCl+H_2O\)
\(HCl+NaAlO_2+H_2O\rightarrow Al\left(OH\right)_3+NaCl\)
\(Al\left(OH\right)_3+3HCl\rightarrow AlCl_3+3H_2O\)
Đúng 3
Bình luận (1)
Rót từ từ dung dịch NaOH vào dung dịch hỗn hợp X chứa a mol HCl và b mol AlCl3 ta có đồ thị sự phụ thuộc số mol kết tủa vào số mol NaOH như sau: Tỉ lệ y:x là: A. 13 B. 14 C. 15 D. 16
Đọc tiếp
Rót từ từ dung dịch NaOH vào dung dịch hỗn hợp X chứa a mol HCl và b mol AlCl3 ta có đồ thị sự phụ thuộc số mol kết tủa vào số mol NaOH như sau:
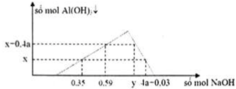
Tỉ lệ y:x là:
A. 13
B. 14
C. 15
D. 16
Rót từ từ dung dịch NaOH vào dung dịch hỗn hợp X chứa a mol HCl và b mol AlCl3 ta có đồ thị sự phụ thuộc số mol kết tủa vào số mol NaOH như sau: Tỉ lệ y:x là: A. 13 B. 14. C. 15. D. 16.
Đọc tiếp
Rót từ từ dung dịch NaOH vào dung dịch hỗn hợp X chứa a mol HCl và b mol AlCl3 ta có đồ thị sự phụ thuộc số mol kết tủa vào số mol NaOH như sau:
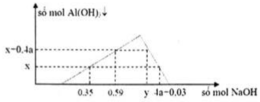
Tỉ lệ y:x là:
A. 13
B. 14.
C. 15.
D. 16.
Bằng phương pháp hóa học hãy nhận biết các dung dịch riêng biệt trong các trường hợp sau:a. Dung dịch AlCl3 và dung dịch NaOH (không dùng thêm hóa chất).b. Dung dịch K2CO3 và dung dịch HCl (không dùng thêm hóa chất).c. Dung dịch KOH 0,1M và dung dịch Ba(OH)2 0,1M (chỉ dùng thêm dung dịch HCl và phenolphtalein).
Đọc tiếp
Bằng phương pháp hóa học hãy nhận biết các dung dịch riêng biệt trong các trường hợp sau:
a. Dung dịch AlCl3 và dung dịch NaOH (không dùng thêm hóa chất).
b. Dung dịch K2CO3 và dung dịch HCl (không dùng thêm hóa chất).
c. Dung dịch KOH 0,1M và dung dịch Ba(OH)2 0,1M (chỉ dùng thêm dung dịch HCl và phenolphtalein).
1) Phân biệt 2 chất trên bằng cách cho từ từ từng giọt dung dịch (1) vào (2) nếu thấy (2) có kết tủa.
+ Nếu kết tủa tan ngay thì (1) là \(AlCl_3\); (2) là NaOH.
| AlCl3 | + | 3NaOH | ⟶ | 2H2O | + | 3NaCl | + | NaAlO2 |
+ Ngược lại, kết tủa tăng dần, đến một lượng dư (1) mới tan thì (1) là NaOH; (2) là \(AlCl_3\)
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
Al(OH)3 + NaOH → NaAlO2 + 2H2O
Đúng 3
Bình luận (0)
2) Phân biệt 2 chất trên bằng cách cho từ từ từng giọt dung dịch (1) vào (2) nếu thấy (2) có khí thoát ra.
+ Nếu khí thoát ra ngay thì (1) là K2CO3; (2) là HCl.
K2CO3 + 2HCl → 2KCl + CO2 + H2O.
+ Ngược lại, sau một thời gian, đến một lượng dư (1) thì mới thấy có bọt khí không màu thoát ra. thì (1) là HCl; (2) là K2CO3
K2CO3 + HCl → KHCO3 + Cl
KHCO3 + HCl → KCl + CO2 + H2O.
Đúng 3
Bình luận (0)
3) Nhỏ 1-2 giọt dung dịch phenolphtalein vào 2 ống nghiệm chứa KOH (1)và Ba(OH)2 (2) thì thấy xuất hiện màu hồng.
Sau đó nhỏ từ từ dung dịch HCl vào ống 1 với lượng là xml dd HCl thì dung dịch mất màu. Nhỏ tương tự xml dd HCl vào ống 2 thì dung dịch vẫn còn màu hồng
Khi đó ta biết được ống 1 là NaOH ống 2 là Ba(OH)2
Vì NaOH, Ba(OH)2 có cùng nồng độ, thể tích => có cùng số mol
Vì nOH-(Ba(OH)2) = 2nOH-(NaOH) nên lượng HCl cần dùng để trung hòa bazo ở ống 2 nhiều hơn ống 1.
NaOH + HCl → NaCl + H2O
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
Đúng 3
Bình luận (0)
Nhỏ từ từ dung dịch NaOH đến dư vào dung dịch hỗn hợp gồm a mol HCl và b mol AlCl3. Kết quả thí nghiệm được biểu diễn theo đồ thị. Tỉ lệ a : b là: A. 4 : 3. B. 2 : 3. C. 1 : 1 D. 2 : l.
Đọc tiếp
Nhỏ từ từ dung dịch NaOH đến dư vào dung dịch hỗn hợp gồm a mol HCl và b mol AlCl3. Kết quả thí nghiệm được biểu diễn theo đồ thị. Tỉ lệ a : b là:
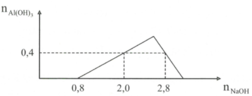
A. 4 : 3.
B. 2 : 3.
C. 1 : 1
D. 2 : l.
Chọn A.
- Các phương trình phản ứng theo thứ tự:
O H - + H + → H 2 O (1)
a a (mol)
3 O H - + A l 3 + → A l ( O H ) 3 ( k t ) (2)
3b b b (mol)
O H - + A l ( O H ) 3 → A l O 2 - + 2 H 2 O (3)
b (mol) b (mol)
- Trên đồ thị, ta thấy:
+ Tại điểm kết tủa 1: n A l ( O H ) 3 = 0 , 4 m o l . Kết hợp với phương trình (2):
n A l ( O H ) 3 = n O H - 3 ⇔ 0 , 4 = 2 - a 3 ⇒ a = 0 , 8 m o l
+ Tại điểm kết tủa 2: n A l ( O H ) 3 = 0 , 4 m o l . Kết hợp với phương trình (2):
n A l ( O H ) 3 = 4 n A l 3 + - n O H - ⇔ 0 , 4 = 4 b - ( 2 , 8 - 0 , 8 ) ⇒ b = 0 , 6 m o l
Do đó: a b = 0 , 8 0 , 6 = 4 3
Đúng 0
Bình luận (0)