Hỗn hợp Cu, Fe, Al nặng 10,15g được hòa atan bằng HNO3 đặc thoát ra 2,24 dm3 khí NO2 (đktc). Nếu hòa tan hh bằng dd HCl dư tì thoát ra 3,92 dm3 khí H2(đktc) . Viết pt phản ứng và tính % khối lượng mỗi KL.

Những câu hỏi liên quan
Hỗn hợp Cu, Fe, Al nặng 10,15g được hòa atan bằng HNO3 đặc thoát ra 2,24 dm3 khí NO2 (đktc). Nếu hòa tan hh bằng dd HCl dư tì thoát ra 3,92 dm3 khí H2(đktc) . Viết pt phản ứng và tính % khối lượng mỗi KL.
Tính số mol " NO2 ; HNO3 ; H2
đặt n,Cu,Al,Fe lần lượt là x,y,z
=> ...
lập hệ
tự giải nhé !
Đúng 0
Bình luận (1)
Hỗn hợp gồm Cu, Fe, Al nặng 10,15g hòa tan bằng HNO3 đặc thoát ra 2,24 lít khí NO2 (đktc) . Nếu hòa tan hỗn hợp bằng HCl dư thoát ra 3,92 lít khí H2(đktc) . Viết phương trình phản ứng và tính % lượng mỗi kim loại
\(PTHH:\text{Cu+4HNO3}\rightarrow\text{Cu(NO3)2+2NO2+2H2O}\)
\(\text{Fe+2HCl}\rightarrow\text{FeCl2+H2}\)
\(\text{2Al+6HCl}\rightarrow\text{2AlCl3+3H2}\)
Gọi a, b lần lượt là số mol của Fe và Al
Ta có :
\(\left\{{}\begin{matrix}\text{nNO2=0,1(mol)}\\\text{nH2=0,175(mol)}\end{matrix}\right.\)
=>nCu=0,05(mol)
=>mCu=0,05x64=3,2(g)
\(\Rightarrow\left\{{}\begin{matrix}\text{56a+27b=6,95}\\\text{a+3b/2=0,175}\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}\text{a=0,1}\\\text{b=0,05}\end{matrix}\right.\)
\(\text{%Cu=3,2/10,15x100=31,53%}\)
\(\text{%Fe=0,1x56/10,15x100=55,17%}\)
\(\text{%Al=13,3%}\)
Cu + 4HNO3 -----> Cu(NO3)2 + 2NO2 + 2H2O
Fe+2HCl---->FeCl2+H2
2Al+6HCl---->2AlCl3+3H2
n\(_{NO2}=\frac{2,24}{22,4}=0,1\left(mol\right)\)
Theo pthh1
n\(_{Cu}=\frac{1}{2}n_{NO2}=0,05\left(mol\right)\)
%m Cu=\(\frac{0,05.64}{10,15}.100\%=31,53\%\)
m\(_{Fe}+m_{Al}=10,15-3,2=6,95\left(g\right)\)
n\(_{H2}=\frac{3,92}{22,4}=0,175\left(mol\right)\)
Gọi n\(_{Fe}=x,n_{Al}=y\)
Theo bài ra ta có pt
\(\)\(\left\{{}\begin{matrix}56x+27y=6,95\\x+1,5x=0,175\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,05\end{matrix}\right.\)
%m\(_{Fe}=\frac{0,1.56}{10,15}.100\%=55,17\text{%}\)
% m Al=100-55,17-31,53=13,3%
https://i.imgur.com/jlgTmi0.jpg
Hòa tan 22,8 g hỗn hợp gồm Al , Zn , Cu bằng dd HCl dư . Sau p/ư thấy thoát ra 11,2 l khí H2 đktc , dd và chất rắn B . Nung B trong kk đến kl ko đổi , cân nặng 5,5 g . Tìm khối lượng mỗi kim loại trong hh ban đầu .
Đặt \(\left\{{}\begin{matrix}n_{Al}=x\\n_{Zn}=y\\n_{Cu}=z\end{matrix}\right.\) ( mol )
\(m_{hh}=27x+65y+64z=22,8\left(g\right)\) (1)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
x 1,5x ( mol )
\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
y y ( mol )
\(n_{H_2}=1,5x+y=\dfrac{11,2}{22,4}=0,5\left(mol\right)\) (2)
B là Cu
\(2Cu+O_2\rightarrow\left(t^o\right)2CuO\)
z z ( mol )
\(n_{CuO}=z=\dfrac{5,5}{80}=0,06875\left(mol\right)\) (3)
\(\left(1\right);\left(2\right);\left(3\right)\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,2\\z=0,06875\end{matrix}\right.\)
\(\left\{{}\begin{matrix}m_{Al}=0,2.27=5,4\left(g\right)\\m_{Zn}=0,2.65=13\left(g\right)\\m_{Cu}=22,8-5,4-13=4,4\left(g\right)\end{matrix}\right.\)
Đúng 6
Bình luận (0)
Hòa tan 10g hỗn hợp Zn và Cu phản ứng hết với dd HCl 5%, sau phản ứng thấy thoát ra 2,24L khí (đktc)
a. Viết pt
b. Tính phần trăm khối lượng mỗi kim loại
c. Tính khối lượng dd HCl đã dùng
Xem chi tiết
a) PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
b) Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)=n_{Zn}\) \(\Rightarrow m_{Zn}=0,1\cdot65=6,5\left(g\right)\)
\(\Rightarrow\%m_{Zn}=\dfrac{6,5}{10}\cdot100\%=65\%\) \(\Rightarrow\%m_{Cu}=35\%\)
c) Theo PTHH: \(n_{HCl}=2n_{Zn}=0,2mol\)
\(\Rightarrow m_{ddHCl}=\dfrac{0,2\cdot36,5}{5\%}=146\left(g\right)\)
Đúng 1
Bình luận (0)
Hỗn hợp X gồm Fe, FeO, Fe2O3 và Fe3O4. Hòa tan X trong 400 ml dung dịch HCl 2M, thấy thoát ra 2,24 lít H2 (đktc) và còn lại 2,8 gam sắt chưa tan. Nếu cho toàn bộ hỗn hợp X vào dung dịch HNO3 đặc nóng (dư) thì thu được bao nhiêu lít khí NO2 (đktc)? A. 4,48 lít. B. 10,08 lít. C. 16,8 lít. D. 20,16 lít.
Đọc tiếp
Hỗn hợp X gồm Fe, FeO, Fe2O3 và Fe3O4. Hòa tan X trong 400 ml dung dịch HCl 2M, thấy thoát ra 2,24 lít H2 (đktc) và còn lại 2,8 gam sắt chưa tan. Nếu cho toàn bộ hỗn hợp X vào dung dịch HNO3 đặc nóng (dư) thì thu được bao nhiêu lít khí NO2 (đktc)?
A. 4,48 lít.
B. 10,08 lít.
C. 16,8 lít.
D. 20,16 lít.
Cho 16,7 gam hỗn hợp Al, Fe, Zn tác dụng với NaOH dư thấy thoát ra 5,04 lít khí (đktc) và một phần chất rắn không tan. Lọc lấy phần không tan hòa tan hết bằng dung dịch HCl dư (không có không khí) thấy thoát ra 2,24 lít (đktc). % khối lượng Al trong hỗn hợp là A. 58,38% B. 24,25% C. 16,17% D. 8,08%
Đọc tiếp
Cho 16,7 gam hỗn hợp Al, Fe, Zn tác dụng với NaOH dư thấy thoát ra 5,04 lít khí (đktc) và một phần chất rắn không tan. Lọc lấy phần không tan hòa tan hết bằng dung dịch HCl dư (không có không khí) thấy thoát ra 2,24 lít (đktc). % khối lượng Al trong hỗn hợp là
A. 58,38%
B. 24,25%
C. 16,17%
D. 8,08%
Khi cho hỗn hợp Al, Fe, Zn vào dung dịch NaOH dư thì chỉ có Zn và Al tham gia phản ứng tạo H2(0,225 mol), phần chất rắn không tan là Fe
Cho Fe phản ứng với lượng dư HCl tạo ra 0,1 mol khí → nFe = nH2 = 0,1 mol → mAl + mZn= 16,7- 5,6 = 11,1
Gọi số mol của Al và Zn lần lượt là x, y
Ta có hệ 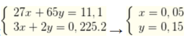
→ %Al = 0 , 05 . 27 16 , 7 ×100% = 8,08 %.
Đáp án D
Đúng 0
Bình luận (0)
hỗn hợp gồm Al, Al2O3 và Cu nặng 10 g. Nếu hòa tan hoàn toàn hỗn hợp bằng axit HCl dư thì thu được 3,36 dm3 khí (đktc); dd B và chất răn A. Đem nung nóng A trong không khí đến khối lượng không đổi thu được chất rắn D cân nặng 2,75g. tính % klg mỗi chất trong hh
giải giúp mik với
2Al+6HCl---->2AlCl3+3H2
Al2o3+6HCl--->2AlCl3+3H2O
Cu+HCl--> không p/u
2Cu + O2---->2CuO
ncuO=2,75/80=0.034375(mol)
Cứ 2 mol Cu---à 2 mol CuO
0.034375<------0.034375
mCu=0,034375.64=2,2(g)
--->%mCu=2,2.100/10=22%
nH2=3,36/22,4=0,15(mol)
cứ 2 mol Al----->3 mol H2
0.1<-----0.15
mAl :0,1.27=2.7(g)
--->%mAl=2,7.100/10=27%
---->%mAl2o3=100%-27%-22%=51%
Đúng 0
Bình luận (0)
hỗn hợp gồm Al, Al2O3 và Cu nặng 10 g. Nếu hòa tan hoàn toàn hỗn hợp bằng axit HCl dư thì thu được 3,36 dm3 khí (đktc); dd B và chất răn A. Đem nung nóng A trong không khí đến khối lượng không đổi thu được chất rắn D cân nặng 2,75g. tính % klg mỗi chất trong hh
giải giùm em với, em cần gấp lắm
cu ko tac dung voi HCl=>2,75g la khoi luong cua Cu => %Cu = 2,75/10*100=27,5%
n H2 = 3,36/22,4= 0,15 mol
pt 2Al + 6HCl -----> 2AlCl3 + 3H2
=> n Al = 2/3n H2 = 2/3 *0,15= 0,1 mol => m Al = 0,1 *27 = 2,7g
=> % Al = 2,7/10*100= 27%
=> %Al2O3 = 100%-27,5%-27%=45,5%
Đúng 1
Bình luận (0)
Cho hh 3 kim loại Fe,Al,Cu nặng 17,4g
- Nếu hoà tan hh bằng dd H2SO4 loãng dư thì thoát ra 8,96 lít H2
- Nếu hoà tan hh bằng dd H2SO4 đặc nóng thì thoát ra 12,32 lít SO2 đktc
Tính khối lượng mỗi KL ban đầu
Nếu số lít SO2 =12.32 thì số mol sẽ là 0.55 nên Kl Cu =35.2(g).Không phù hợp yêu cầu của đề bài.
Đúng 0
Bình luận (0)
ca 3 cai fe cu va al deu td voi axit h2s04 dac nong
Đúng 0
Bình luận (0)























