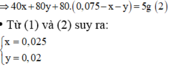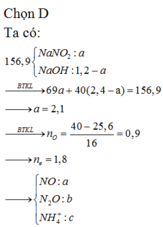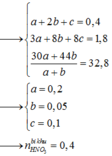mọi người ơi giúp mjk với
hòa tan 2,29 g hổn hợp Ba,Na vào nước thu được dung dịch A và 6,67 khí ở đktc. cho từ từ dung dịch Fecl3 (dư) vào dung dich A , lọc lấy kết quả rửa sạch làm khô và nung đến khối lượng không đổi thu được m g chất rắn. tính m ???