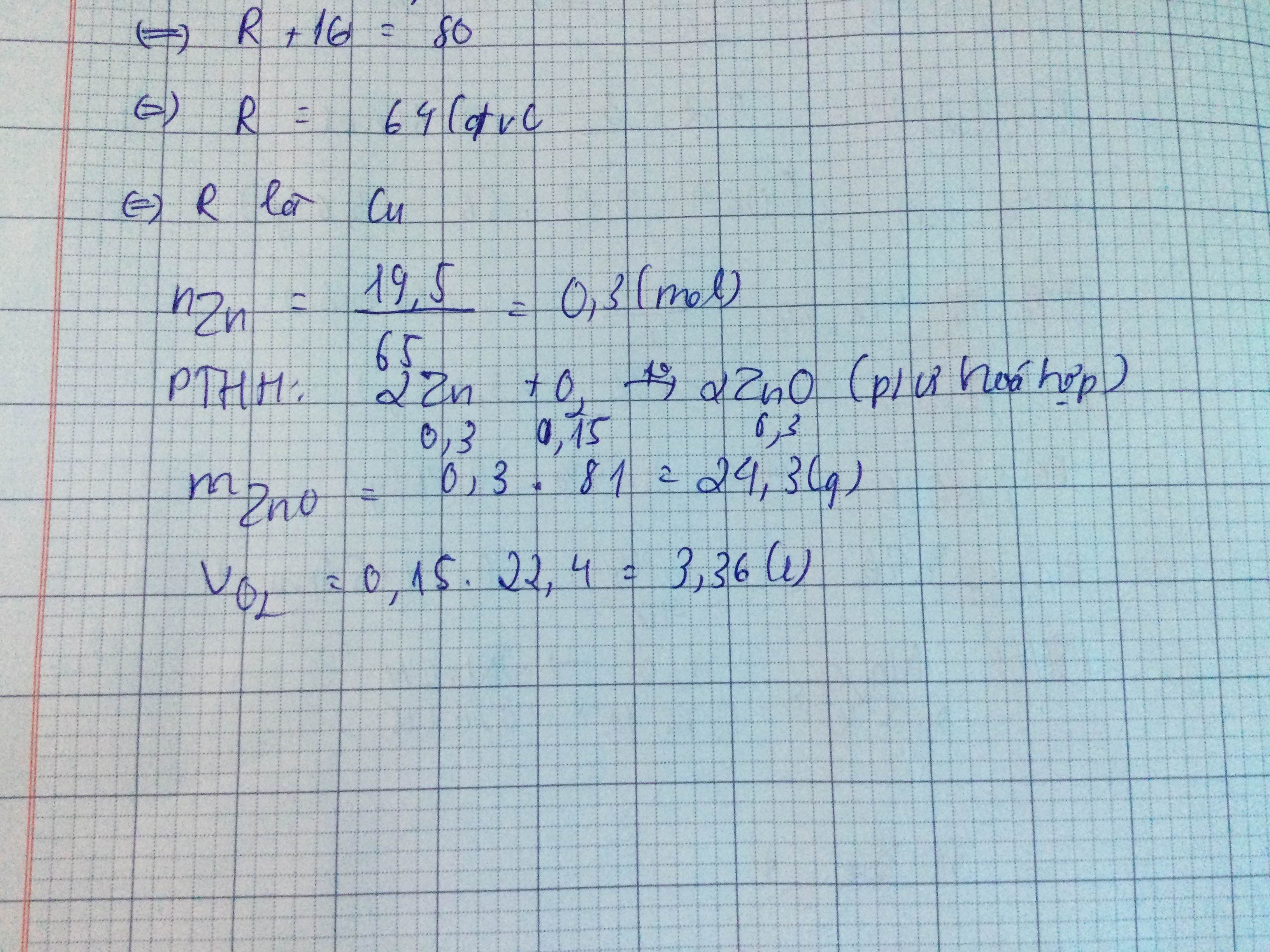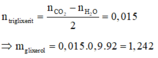Đốt 7g lưu huỳnh thu được 4,48 l Khí So(đkc). Tính hiệu suất phản ứng

Những câu hỏi liên quan
Khử m gam bột CuO bằng khí H2 ở nhiệt độ cao thu được hỗn hợp chất rắn X. Để hòa tan hết X cần vừa đủ 1 lít dung dịch HNO3 1M, thu được 4,48 lít NO (đktc). Hiệu suất của phản ứng khử CuO bằng bao nhiêu?
A. 70%
B. 75%
C. 80%
D. 85%
Đáp án B
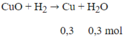
Số mol HNO3 nHNO3 = 1.1 = 1 mol
Số mol NO nNO = 4,48/22,4 = 0,2 mol
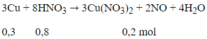
HNO3 còn 1 - 0,8 = 0,2 mol → CuO dư
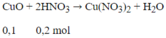
Ban đầu 0,4 mol CuO, phản ứng 0,3 mol CuO
⇒ Hiệu suất H = (0,3/0,4).100% = 75%
Đúng 0
Bình luận (0)
/ Đốt cháy hoàn toàn 19,5g Zn trong khí oxi thu được ZnO.
a/ Viết PTHH. Phản ứng trên thuộc loại phản ứng nào?
b/ Tính khối lượng ZnO tạo thành
c/ Tính thể tích O2 PƯ
\(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{19,5}{65}=0,3mol\)
\(Zn+\dfrac{1}{2}O_2\rightarrow\left(t^o\right)ZnO\)
1 1/2 1 (mol)
0,3 0,15 0,3 ( mol )
PƯ trên thuộc loại phản ứng hóa hợp
\(m_{ZnO}=n_{ZnO}.M_{ZnO}=0,3.81=24,3g\)
\(V_{O_2}=n_{O_2}.22,4=0,15.22,4=3,36l\)
Đúng 2
Bình luận (4)
a. \(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
PTHH : 2Zn + O2 -> 2ZnO ( Phản ứng hóa hợp )
0,3 0,15 0,3
b. \(m_{ZnO}=0,3.81=24,3\left(g\right)\)
c. \(V_{O_2}=0,15.22,4=3,36\left(l\right)\)
Đúng 1
Bình luận (1)
Câu 3 : Đốt cháy 2,4 g magnesium , trong khí oxygen thu được 8,8 Magnesium ocide . Tính khối lượng Oxygen tham gia phản phản ứng ?
Xem chi tiết
Theo ĐLBT KL, có: mMg + mO2 = mMgO
⇒ mO2 = 8,8 - 2,4 = 6,4 (g)
Đúng 1
Bình luận (3)
Đốt cháy 5,4 g Aluminium trong bình đựng khí Oxygen tinh khiết, sau phản ứng thu được Aluminium oxide.
a) Viết PTHH. Tính khối lượng Aluminium oxide thu được
b) Để có được lượng oxygen dùng cho phản ứng trên thì cần nhiệt phân bao nhiêu gam KClO3?
\(n_{Al}=\dfrac{5,4}{27}=0,2mol\)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
0,2 0,15 0,1
\(m_{Al_2O_3}=0,1\cdot102=10,2g\)
\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
0,1 0,15
\(m_{KClO_3}=0,1\cdot122,5=12,25g\)
Đúng 2
Bình luận (0)
\(PTHH:4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
\(n_{Al}=5,4:27=0,2\left(mol\right)\)
\(\Rightarrow n_{Al_2O_3}=0,2.2:4=0,1\left(mol\right);n_{O_2}=0,2.3:4=0,15\left(mol\right)\)
\(m_{Al_2O_3}=0,1.102=10,2\left(g\right)\)
b)\(PTHH:2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
\(n_{O_2}=0,15\left(mol\right)\)(câu a)
\(\Rightarrow n_{KClO_3}=0,15.2:3=0,1\left(mol\right)\)
\(m_{KClO_3}=0,1.123,5=12,35\left(g\right)\)
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn m gam chất béo X (chứa axit stearic, axit panmitic và các triglixerit của các axit này). Sau phản ứng thu được 20,16 lít CO2 (điều kiện tiêu chuẩn) và 15,66 gam nước. Xà phòng hóa m gam X (hiệu suất phản ứng bằng 90%) thì thu được khối lượng glixerol là A. 2,484 gam B. 1,242 gam C. 1,380 gam D. 2,760 gam
Đọc tiếp
Đốt cháy hoàn toàn m gam chất béo X (chứa axit stearic, axit panmitic và các triglixerit của các axit này). Sau phản ứng thu được 20,16 lít CO2 (điều kiện tiêu chuẩn) và 15,66 gam nước. Xà phòng hóa m gam X (hiệu suất phản ứng bằng 90%) thì thu được khối lượng glixerol là
A. 2,484 gam
B. 1,242 gam
C. 1,380 gam
D. 2,760 gam
nung nóng 8,96 lít hỗn hợp khí X gồm SO2 và O2 ( tỷ lệ mol 1:1) với xúc tác V2O5 sau 1 thời gian thu được hỗn hợp khi y, dẫn y vào dung dịch Ba(OH)2 dư thu được 45,8g kết tủa. tính hiệu suất phản ứng, biết rằng các thể tích khí đều được đo ở đktc, phản ứng hóa học đã xảy ra như thế nào.
\(n_{hh}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Do SO2 và O2 tỉ lệ mol 1:1
=> \(n_{SO_2}=n_{O_2}=0,2\left(mol\right)\)
\(2SO_2+O_2-^{t^o,V_2O_5}\rightarrow2SO_3\)
Lập tỉ lệ : \(\dfrac{0,2}{2}< \dfrac{0,2}{1}\) => Sau phản ứng O2 dư, tính theo số mol của SO2
Theo PT: \(n_{SO_3}=n_{SO_2}=0,2\left(mol\right)\)
Hỗn hợp khí Y gồm SO3, O2
\(SO_3+Ba\left(OH\right)_2\rightarrow BaSO_4\)
\(n_{BaSO_4}=n_{SO_3}=0,2\left(mol\right)\)
\(\Rightarrow m_{BaSO_{\text{4 }}\left(lt\right)}=0,2.233=46,6\left(g\right)\)
Thực tế chỉ thu được 45,8g kết tủa
\(\Rightarrow H=\dfrac{45,8}{46,6}=98,28\%\)
Đúng 1
Bình luận (0)
Cho 6,4g hỗn hợp A gồm Fe và Mg phản ứng với 100g dung dịch H2SO4 loãng vừa đủ được 3,584 lít (đkc) và dung dịch B a, tính % theo khối lượng mỗi chất có trong A b, tính C% của từng muối trong dung dịch B c, đốt cháy 6,4g hỗn hợp A ở trên với hỗn hợp khí X gồm Cl2 và O2, sau phản ứng chỉ thu được hỗn hợp Y gồm các oxit và muối clorua (không có khí dư). Hòa tan Y bằng 1 lượng vừa đủ 120ml dung dịch HCl 2M thu được dung dịch Z. Cho AgNO3 dư v...
Đọc tiếp
Cho 6,4g hỗn hợp A gồm Fe và Mg phản ứng với 100g dung dịch H2SO4 loãng vừa đủ được 3,584 lít (đkc) và dung dịch B a, tính % theo khối lượng mỗi chất có trong A b, tính C% của từng muối trong dung dịch B c, đốt cháy 6,4g hỗn hợp A ở trên với hỗn hợp khí X gồm Cl2 và O2, sau phản ứng chỉ thu được hỗn hợp Y gồm các oxit và muối clorua (không có khí dư). Hòa tan Y bằng 1 lượng vừa đủ 120ml dung dịch HCl 2M thu được dung dịch Z. Cho AgNO3 dư vào dung dịch Z thu được 56,69g kết tủa. Tính % theo thể tính của Cl2 trong hỗn hợp X
Câu 2:,lưu huỳnh chảy trong khí oxi tạo thành khí lưu huỳnh đioxít
A,viết phương trình hóa học của phản ứng
B,biết sau lưu huỳnh đioxít thất thoát 20% khối lượng,khối lượng oxi và lưu huỳnh ban đầu đem đốt cùng 64g.Tính khối lượng lưu huỳnh đioxít sau cùng thu được
a)\(S+O_2-^{t^o}\rightarrow SO_2\)
b)Áp dụng ĐLBTKL: mO2+mS=mSO2
⇒mSO2 =64+64=128(g)
Do bị thất thoát 20%
⇒mSO2=\(\frac{128}{100}.80\)=102,4(g)
Đúng 0
Bình luận (0)
ĐỀ 3
Câu 1: Thế nào là sự oxi hóa ? Cho ví dụ
Câu 2: Cân bằng phương trình và cho biết phản ứng nào là phản ứng hóa hợp?
a. P2O5 + H2O - H3PO4
b. C3H6 + O2 - CO2 + H2O
c. Al + HCl - AlCl3 + H2
d. Na + O2 - Na2O
e. KMnO4 - K2MnO4 + MnO2 + O2
Câu 3: Cho SO3 , KOH , Na2O , CO2 , CaO , H2SO4. Xác định oxit axit , oxit bazơ và đọc tên
Câu 4: Nêu hiện tượng và viết phương trình hóa học khi đốt cháy photpho trong oxi.
Câu 5: Đốt cháy lưu huỳnh trong bìn...
Đọc tiếp
ĐỀ 3
Câu 1: Thế nào là sự oxi hóa ? Cho ví dụ
Câu 2: Cân bằng phương trình và cho biết phản ứng nào là phản ứng hóa hợp?
a. P2O5 + H2O -> H3PO4
b. C3H6 + O2 -> CO2 + H2O
c. Al + HCl -> AlCl3 + H2
d. Na + O2 -> Na2O
e. KMnO4 -> K2MnO4 + MnO2 + O2
Câu 3: Cho SO3 , KOH , Na2O , CO2 , CaO , H2SO4. Xác định oxit axit , oxit bazơ và đọc tên
Câu 4: Nêu hiện tượng và viết phương trình hóa học khi đốt cháy photpho trong oxi.
Câu 5: Đốt cháy lưu huỳnh trong bình đựng khí oxi thu được 24g khí lưu huỳnh đioxit
a. Viết phương trinh phản ứng
b. Tính khối lượng lưu huỳnh tham gia phản ứng.
c. Tính thể tích khí oxi đã dùng (đktc)
https://i.imgur.com/o8hPqcM.jpg
a,\(S+O_2\underrightarrow{^{to}}SO_2\)
b,
nSO2= 0,375 mol= nS
=> mS= 12g
c,
BTKL, mO2= 24-12= 12g
Câu 1:
Oxi hóa là có sự tham gia của oxi trong Pứ
VD: \(S+O_2\underrightarrow{t^o}SO_2\)
Câu 2:
\(a,P_2O_5+3H_2O\rightarrow2H_3PO_4\)
\(b,2C_3H_6+9O_2\underrightarrow{t^o}6CO_2+6H_2O\)
\(c,2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(d,4Na+O_2\underrightarrow{t^o}2Na_2O\)
\(e,2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
Câu 3:
Oxit axit:
SO3: Lưu huỳnh trioxit
CO2: Cacbon đioxit
H2SO4: axit sunfuric
Còn lại là oxit bazo
4. Photpho cháy sáng trong khí oxi, có khói trắng, khi khói trắng tan thì có lớp chất bột màu trắng bám quanh thành bình.
PTHH: 4P + 5O2 to→to 2P2O5
Câu 5:
a) \(n_{SO_2}=\frac{24}{64}=0,375\left(mol\right)\)
S+O2->to SO2
0,375---------->(mol)
b) \(m_S=0,375.32=12\left(g\right)\)
c) \(V_{O_2}=0,375.22,48,4\left(l\right)\)
Xem thêm câu trả lời