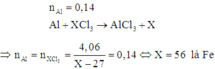Mong mọi người giúp em , em đang ôn lại các dạng bài để thi học kì , còn vài ngày nữa thi rồi nên mong mọi người giải đáp giúp em ạ , em cảm ơn nhiều : Câu 1 : Cho 10g hỗn hợp 2 kim loại : Al và Cu tác dụng với dung dịch H2SO4 20% thu được 6.72 lít khi H2 ( ĐKTC) a) Tính khối lượng các chất có trong hỗn hợp b) Tình khối lượng H2S04 cần dùng Câu 2 : Cho 20g hỗn hợp 2 muối là NaCl và Na2CO3 tác dụng vừa đủ với 400 Ml dung dịch HCl a) Tính nồng độ mol của dung dịch HCl b) Tính phần trâm theo khối...
Đọc tiếp
Mong mọi người giúp em , em đang ôn lại các dạng bài để thi học kì , còn vài ngày nữa thi rồi nên mong mọi người giải đáp giúp em ạ , em cảm ơn nhiều :">
Câu 1 : Cho 10g hỗn hợp 2 kim loại : Al và Cu tác dụng với dung dịch H2SO4 20% thu được 6.72 lít khi H2 ( ĐKTC)
a) Tính khối lượng các chất có trong hỗn hợp
b) Tình khối lượng H2S04 cần dùng
Câu 2 : Cho 20g hỗn hợp 2 muối là NaCl và Na2CO3 tác dụng vừa đủ với 400 Ml dung dịch HCl
a) Tính nồng độ mol của dung dịch HCl
b) Tính phần trâm theo khối lượng của mỗi muối trong hỗn hợp ban đầu
Câu 3 : Một sợi dây Al có khối lượn là 16,2g được nhúng vào dung dịch CuSO4 25%
a) Khối lượng dung dịch CuSO4 25% dùng đẻ làm tan hết sợi Al
b) Khối lượng Cu tạo thành sau phản ứng
Câu 4 : Cho 200g dung dịch BaCl2 10,4% tác dụng vừa đủ với 400g dung dịch Na2SO4
a) Khối lượng kết tủa tạo thành
b) Nồng độ % của chất còn lại trong dung dịch sau khi lọc bỏ kết tủa
Câu 5 : Cho 200 ml dung dihcj AgNO3 ; 2M tác dụng vừa đủ
a) Hiện tượng quan sát được ? PT ?
b) Khối lượng chất rắn sinh ra
c) Nồng độ mol của dung dịch sau phản ứng
Câu 6 : Cho bột săt dư tác dụng với 100g ml dung dịch CuSO4 1M . Sau khi phản ứng kết thúc , lọc được chất rắn A và dung dịch B
a) Cho A tác dụng với dung dịch HCl dư . Tính khối lượng chất rắn còn lại sau phản ứng
b) Khối lượng dung dịch NaOH 20% vừa đủ đẻ kết tủa hoàn toàn dung dịch B