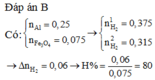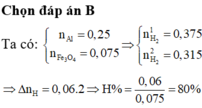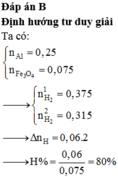Khử hoàn toàn 4.64g Fe3O4 bằng khí H2 rồi dẫn toàn bộ lượng H2O vào trong 700g đ HCl 12% thì thu được dd mới có CM bằng bao nhiêu biết hiệu suất phản ứng khử đạt 70%

Những câu hỏi liên quan
Bài 12. Để khử hoàn toàn 13g kẽm trong dung dịch axit HCl thu được bao nhiêu lít khí H2 (đktc)? Dẫn toàn bộ khí thu được qua 23,2g bột Fe3O4, hãy tính khối lượng kim loại thu được.
Mọi người giải chi tiết giúp mik vs ạ!!
Mik đg cần gấp ạ
Zn + 2 HCl -> ZnCl2 + H2
nZn=0,2(mol) -> nH2=0,2(mol)
PTHH: Fe3O4 + 4 H2 -to-> 3 Fe + 4 H2O
nFe3O4=23,2/232=0,1(mol)
Ta có: 0,1/1 > 0,2/4
=> H2 hết, Fe3O4 dư, tính theo nH2
=> nFe=3/4. 0,2=0,15(mol)
=> mFe=0,15. 56=8,4(g)
Đúng 2
Bình luận (0)
trộn 5,4 gam nhôm và 17,4 gam Fe3O4 rồi tiến hành phản ứng nhiệt nhôm. Giả sử chỉ xảy ra quá trình khử Fe3O4 thành Fe. Hòa tan hoàn toàn hỗn hợp rắn sau phản ứng vào dd H2SO4 loãng thu được 5,376 lít khí H2(đktc). Tính hiệu suất của phản ứng nhiệt nhôm.
$n_{Al} = 0,2(mol) ; n_{Fe_3O_4} = 0,075(mol)$
$8Al + 3Fe_3O_4 \xrightarrow{t^o} 9Fe + 4Al_2O_3$
Vì $n_{Al} : 8 = n_{Fe_3O_4} : 3$ nên gọi hiệu suất là a
Suy ra: $n_{Al\ pư} = 0,2a(mol) ; n_{Al\ dư} = 0,2 - 0,2a(mol)$
$n_{Fe} = \dfrac{9}{8}n_{Al} = 0,225a(mol)$
Mà :
$n_{H_2} = 1,5n_{Al} + n_{Fe} = 1,5(0,2 - 0,2a) + 0,225a = \dfrac{5,376}{22,4}$
$\Rightarrow a = 0,8 = 80\%$
Đúng 3
Bình luận (0)
Dẫn H2 khử hoàn toàn Fe3O4 thu được 16,8g Fe
a) Viết PTHH
b) Vo2 phản ứng (đktc)
c) Số phân tử H2O
d) Khối lượng Fe3O4 phản ứng
Fe3O4+4H2-to>3Fe+4H2O
0,1-------0,4------0,3-----0,4
n Fe=\(\dfrac{16,8}{56}\)=0,3 mol
=>VH2=0,4.22,4=8,96l
=>số pt H2O=0,4.6.1023=2,4.1023 pt
=>m Fe3O4= 0,1.232=23,2g
Đúng 6
Bình luận (1)
nFe = 16,8/56 = 0,3 (mol)
PTHH: Fe3O4 + 4H2 -> (t°) 3Fe + 4H2O
Mol: 0,1 <--- 0,4 <--- 0,3 ---> 0,4
VH2 = 0,4 . 22,4 = 8,96 (l)
Số phân tử H2O: 0,4 . 6.10^23 = 2,4.10^23 (phân tử)
mFe3O4 = 0,1 . 232 = 23,2 (g)
Đúng 2
Bình luận (1)
Trộn 6,75 gam bột Al với 17,4 gam bột Fe3O4 rồi tiến hành phản ứng nhiệt nhôm (không có không khí). Giả sử chỉ xảy ra phản ứng khử Fe3O4 thành Fe. Hòa tan hoàn toàn chất rắn sau phản ứng bằng dung dịch H2SO4 loãng dư thu được 7,056 lít khí H2 (đktc). Hiệu suất phản ứng nhiệt nhôm là: A. 75%. B. 80%. C. 60%. D. 75%.
Đọc tiếp
Trộn 6,75 gam bột Al với 17,4 gam bột Fe3O4 rồi tiến hành phản ứng nhiệt nhôm (không có không khí). Giả sử chỉ xảy ra phản ứng khử Fe3O4 thành Fe. Hòa tan hoàn toàn chất rắn sau phản ứng bằng dung dịch H2SO4 loãng dư thu được 7,056 lít khí H2 (đktc). Hiệu suất phản ứng nhiệt nhôm là:
A. 75%.
B. 80%.
C. 60%.
D. 75%.
Trộn 6,75 gam bột Al với 17,4 gam bột Fe3O4 rồi tiến hành phản ứng nhiệt nhôm (không có không khí). Giả sử chỉ xảy ra phản ứng khử Fe3O4 thành Fe. Hòa tan hoàn toàn chất rắn sau phản ứng bằng dung dịch H2SO4 loãng dư thu được 7,056 lít khí H2 (đktc). Hiệu suất phản ứng nhiệt nhôm là: A. 75 %. B. 80 %. C. 60%. D. 75 %.
Đọc tiếp
Trộn 6,75 gam bột Al với 17,4 gam bột Fe3O4 rồi tiến hành phản ứng nhiệt nhôm (không có không khí). Giả sử chỉ xảy ra phản ứng khử Fe3O4 thành Fe. Hòa tan hoàn toàn chất rắn sau phản ứng bằng dung dịch H2SO4 loãng dư thu được 7,056 lít khí H2 (đktc). Hiệu suất phản ứng nhiệt nhôm là:
A. 75 %.
B. 80 %.
C. 60%.
D. 75 %.
Trộn 6,75 gam bột Al và 17,4 gam bột
F
e
3
O
4
rồi tiến hành phản ứng nhiệt nhôm (không có không khí). Giả sử chỉ xảy ra phản ứng khử
F
e
3
O
4
thành Fe. Hòa tan hoàn toàn chất rắn sau phản ứng bằng dung dịch
H
2
S
O
4
loãng dư thu được...
Đọc tiếp
Trộn 6,75 gam bột Al và 17,4 gam bột F e 3 O 4 rồi tiến hành phản ứng nhiệt nhôm (không có không khí). Giả sử chỉ xảy ra phản ứng khử F e 3 O 4 thành Fe. Hòa tan hoàn toàn chất rắn sau phản ứng bằng dung dịch H 2 S O 4 loãng dư thu được 7,056 lít khí H2 (đktc). Hiệu suất phản ứng nhiệt nhôm là:
A. 75%.
B. 80%.
C. 60%.
D. 75%.
Trộn 6,75 gam bột Al với 17,4 gam bột Fe3O4 rồi tiến hành phản ứng nhiệt nhôm (không có không khí). Giả sử chỉ xảy ra phản ứng khử Fe3O4 thành Fe. Hòa tan hoàn toàn chất rắn sau phản ứng bằng dung dịch H2SO4 loãng dư thu được 7,056 lít khí H2 (đktc). Hiệu suất phản ứng nhiệt nhôm là A. 75 %. B. 80 %. C. 60%. D. 75 %.
Đọc tiếp
Trộn 6,75 gam bột Al với 17,4 gam bột Fe3O4 rồi tiến hành phản ứng nhiệt nhôm (không có không khí). Giả sử chỉ xảy ra phản ứng khử Fe3O4 thành Fe. Hòa tan hoàn toàn chất rắn sau phản ứng bằng dung dịch H2SO4 loãng dư thu được 7,056 lít khí H2 (đktc). Hiệu suất phản ứng nhiệt nhôm là
A. 75 %.
B. 80 %.
C. 60%.
D. 75 %.
: Khử hoàn toàn 12,8 gam Fe2O3 bằng khí hiđro ở nhiệt độ cao. a. Tính thể tích hiđro cần dùng ở đktc?b. Tính khối lượng Fe thu được sau phản ứng?c. Nếu đem toàn bộ lượng Fe thu được ở trên tác dụng với 14,6 gam axit HCl thì thu được bao nhiêu lít H2 (đktc)?
Đọc tiếp
: Khử hoàn toàn 12,8 gam Fe2O3 bằng khí hiđro ở nhiệt độ cao.
a. Tính thể tích hiđro cần dùng ở đktc?
b. Tính khối lượng Fe thu được sau phản ứng?
c. Nếu đem toàn bộ lượng Fe thu được ở trên tác dụng với 14,6 gam axit HCl thì thu được bao nhiêu lít H2 (đktc)?
Để giải bài toán này, ta cần biết phương trình phản ứng giữa oxit sắt (Fe2O3) và khí hidro (H2):
Fe2O3 + 3H2 → 2Fe + 3H2O
Theo đó, mỗi mol Fe2O3 cần 3 mol H2 để khử hoàn toàn thành Fe.
a) Thể tích khí hiđro cần dùng:
Ta cần tìm số mol khí hidro cần dùng để khử hoàn toàn 12,8 gam Fe2O3.Khối lượng mol của Fe2O3 là:M(Fe2O3) = 2x56 + 3x16 = 160 (g/mol)
Số mol Fe2O3 là:n(Fe2O3) = m/M = 12.8/160 = 0.08 (mol)
Theo phương trình phản ứng, mỗi mol Fe2O3 cần 3 mol H2 để khử hoàn toàn thành Fe.Vậy số mol H2 cần dùng là:n(H2) = 3*n(Fe2O3) = 0.24 (mol)
Thể tích khí hidro cần dùng ở đktc là:V(H2) = n(H2)22.4 = 0.2422.4 = 5.376 (lít)
Vậy thể tích khí hiđro cần dùng ở đktc là 5.376 lít.
b) Khối lượng Fe thu được sau phản ứng:
Theo phương trình phản ứng, mỗi mol Fe2O3 tạo ra 2 mol Fe.Vậy số mol Fe thu được là:n(Fe) = 2*n(Fe2O3) = 0.16 (mol)
Khối lượng Fe thu được là:m(Fe) = n(Fe)M(Fe) = 0.1656 = 8.96 (gam)
Vậy khối lượng Fe thu được sau phản ứng là 8.96 gam.
c) Thể tích khí hiđro thu được khi Fe tác dụng với HCl:
Ta cần tìm số mol H2 thu được khi Fe tác dụng với HCl.Theo phương trình phản ứng, mỗi mol Fe tác dụng với 2 mol HCl để tạo ra H2 và muối sắt (FeCl2).Số mol HCl cần dùng để tác dụng với Fe là:n(HCl) = m(HCl)/M(HCl) = 14.6/36.5 = 0.4 (mol)
Vậy số mol H2 thu được là:n(H2) = 2n(Fe) = 2(m(Fe)/M(Fe)) = 2*(8.96/56) = 0.16 (mol)
Thể tích khí hiđro thu được ở đktc là:V(H2) = n(H2)22.4 = 0.1622.4 = 3.584 (lít)
Vậy thể tích khí hiđro thu được ở đktc là 3.584 lít.

Đúng 0
Bình luận (0)
Khử hoàn toàn 24 gam Fe3O4 bằng khí H2(nung nóng),thu được sắt kim loại và nước. a. Viết PTHH xảy ra b. Tính thể tích khí H2(ở đktc) thu được c. Tính thể tích dd HCl 1.5M cần dùng để hòa tan hết lượng sắt tạo thành từ phản ứng trên.
\(n_{Fe_3O_4}=\dfrac{24}{232}=\dfrac{3}{29}\left(mol\right)\)
PTHH :
\(Fe_3O_4+4H_2\underrightarrow{t^o}3Fe+4H_2O\)
3/29 9/29
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
9/29 18/29
\(c,V_{HCl}=\dfrac{\dfrac{18}{29}}{1,5}=\dfrac{12}{29}\left(l\right)\)
Đúng 3
Bình luận (0)