1. Ngâm 12g hỗn hợp các kim loại Fe, Cu trong dung dịch CuSO4 dư, phản ứng xong thu được chất rắn có khối lượng là 12,8g. Tính %m mỗi kim loại trong hh đầu

Những câu hỏi liên quan
Ngâm 15 gam hỗn hợp Fe và Cu trong dung dịch CuSO4 dư. Phản ứng xong thu được 16 gam chất rắn. Thành phần phần trăm khối lượng của mỗi kim loại trong hỗn hợp ban đầu tương ứng là:
A. 53,34% và 46,66%
B. 46,67% và 53,33%
C. 40% và 60%
D. 60% và 40%
Đáp án B
Phương trình phản ứng:
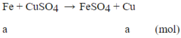
m tăng = (64-56).a = 1 ⇒a=0,125 mol
nFe = 0,125 ⇒nCu = (15-56.0,125)/64 = 0,125 mol
Thành phần phần trăm theo khối lượng:
⇒ % mCu = 53,33
Đúng 0
Bình luận (0)
Ngâm 12g hỗn hợp kim loại Fe , Cu trong dung dịch CuSO4 dư phản ứng xong thu được chất rắn có khối lượng 12,8g
a, viết PTPƯ
b, tính thành phần %theo khối lượng
Fe + CuSO4 -> FeSO4 + Cu
Gọi nFe =a
Ta có:
64a-56a=0,8
=>a=0,1(mol)
mFe=56.0,1=5,6(g)
%mFe=\(\dfrac{5,6}{12}.100\%=46,67\%\)
%mCu=100-46,67%=53,33%
Đúng 0
Bình luận (0)
Câu 45: Cho 100 gam hỗn hợp gồm 2 kim loại Fe, Cu vào dung dịch CuSO4 dư sau phản ứng thấy khối lượng chất rắn thu được tăng thêm 4 gam so với ban đầu. Vậy phần trăm khối lượng của Cu trong hỗn hợp ban đầu là
\(PT:Fe+Cu3O_4\rightarrow FeSO_4+Cu\)
\(m\uparrow=-mFe+mCu=4\left(g\right)\)
\(nFe=\dfrac{4}{-56+64}=0,5\left(mol\right)\)
\(\Rightarrow mFe=28\left(g\right)\Rightarrow mCu=72\)
Đúng 4
Bình luận (0)
Ngâm 16,6 g hỗn hợp hai kim loại Al và Fe trong dung dịch HCl dư phản ứng xong người ta thu được 11,2 l khí H2(đktc) a.viết các phương trình hóa học b.tính khối lượng mỗi kim loại trong hỗn hợp ban đầu
a)
\(2Al + 6HCl \to 2AlCl_3 + 3H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ b)\\ n_{Al} = a(mol) ; n_{Fe} = b(mol) \Rightarrow 27a + 56b =16,6(1)\\ n_{H_2} = 1,5a + b = \dfrac{11,2}{22,4} = 0,5(2)\\ (1)(2)\Rightarrow a = 0,2 ; b = 0,2\\ \Rightarrow m_{Al} = 0,2.27 = 5,4(gam)\ ;\ m_{Fe} = 0,2.56 = 11,2(gam)\)
Đúng 2
Bình luận (0)
Cho 8,0 gam hỗn hợp kim loại Fe và Cu vào dung dịch HCl loãng dư, sau khi phản ứng xảy ra hoàn toàn thu được 3,2 gam chất rắn không tan. Tính % về khối lượng của mỗi kim loại trong hỗn hợp ban đầu
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Chất rắn không tan : Cu
\(m_{Cu}=3.2\left(g\right)\Rightarrow m_{Fe}=8-3.2=4.8\left(g\right)\)
\(\%Fe=\dfrac{4.8}{8}\cdot100\%=60\%\)
\(\%Cu=100\%-60\%=40\%\)
Đúng 3
Bình luận (1)
\(m_{rắn}=m_{Cu}=3,2g\\ \%m_{Cu}=\dfrac{3,2}{8}\cdot100\%=40\%\\ \%m_{Fe}=100\%-40\%=60\%\)
Đúng 2
Bình luận (1)
Hòa tan 12g hỗn hợp gồm Cu và Fe vào dung dịch axit HCl thu được 2,24 lít khí.
a. Viết phương trình phản ứng xảy ra.
b. Tìm khối lượng mỗi kim loại trong hỗn hợp ban đầu
3. Tính thành phần % theo khối lượng các kim loại trong hỗn hợp ban đầu
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,1 0,1 ( mol )
( Cu không tác dụng với dd axit HCl )
\(m_{Fe}=0,1.56=5,6g\)
\(\rightarrow m_{Cu}=12-5,6=6,4g\)
\(\rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{5,6}{12}.100=46,66\%\\\%m_{Cu}=100\%-46,66\%=53,34\%\end{matrix}\right.\)
Đúng 3
Bình luận (0)
Câu 9: Ngâm 21,6 g hỗn hợp 3 kim loại Zn, Fe và Cu trong dung dịch H2SO4 loãng, dư. Phản ứng xong, thu được 3g chất rắn không tan và 6,72l khí (ở đktc).
a) Viết PTHH xảy ra
b) Xác định thành phần phần trăm của mỗi kim loại trong hỗn hợp
a)Zn +H2SO4 -> ZnSO4 +H2
Fe +H2SO4 -> FeSO4 +H2
Cu +H2SO4 -> CUSO4+H2
đặt số mol 3 KL Zn, Fe, Cu lần lượt là a, b, c (mol), ta có pt theo đề bài:
65a+56b+64c=21.6 (1)
c=3/64 (2)
a+b=6.72/22.4 (3)
Từ (1)(2)(3)==> a=0.2(mol), b=0.1(mol), c=3/64(mol)
==>%Zn=0.2 x 65 x100/21.6 = 60.185%
%Fe=0.1 x 56 x 100/21.6 = 25.925%
%Cu=100%-( 60.185% + 25.925% )= 13.89%
Đúng 1
Bình luận (0)
Ngâm 12g hỗn hợp gồm Fe, Al, Cu vào dung dịch HCl đủ thu được dung dịch A và 8,96l khí B(đ.k.t.c) và 4,8g chất rắn không tan. Tính % m mỗi kim loại trong hỗn hợp
Ngâm 21,6g hỗn hợp 3 kim loại Zn ,Fe,Cu trong dung dịch H2SO4 Phản ứng thu được 3g chất rắn không tan và 6,72 lít khí đktc
Xác định % Khối lượng của mỗi chất trong hỗn hợp
phương trình bn tự ghi nha:
đặt số mol 3 KL Zn, Fe, Cu lần lượt là a, b, c (mol), ta có pt theo đề bài:
65a+56b+64c=21.6 (1)
c=3/64 (2)
a+b=6.72/22.4 (3)
Từ (1)(2)(3)==> a=0.2(mol), b=0.1(mol), c=3/64(mol)
==>%Zn=0.2x65x100/21.6=60.185%
%Fe=0.1x56x100/21.6=25.925%
%Cu=100%-(60.185%+25.925%)=13.89%
Đúng 1
Bình luận (6)

























