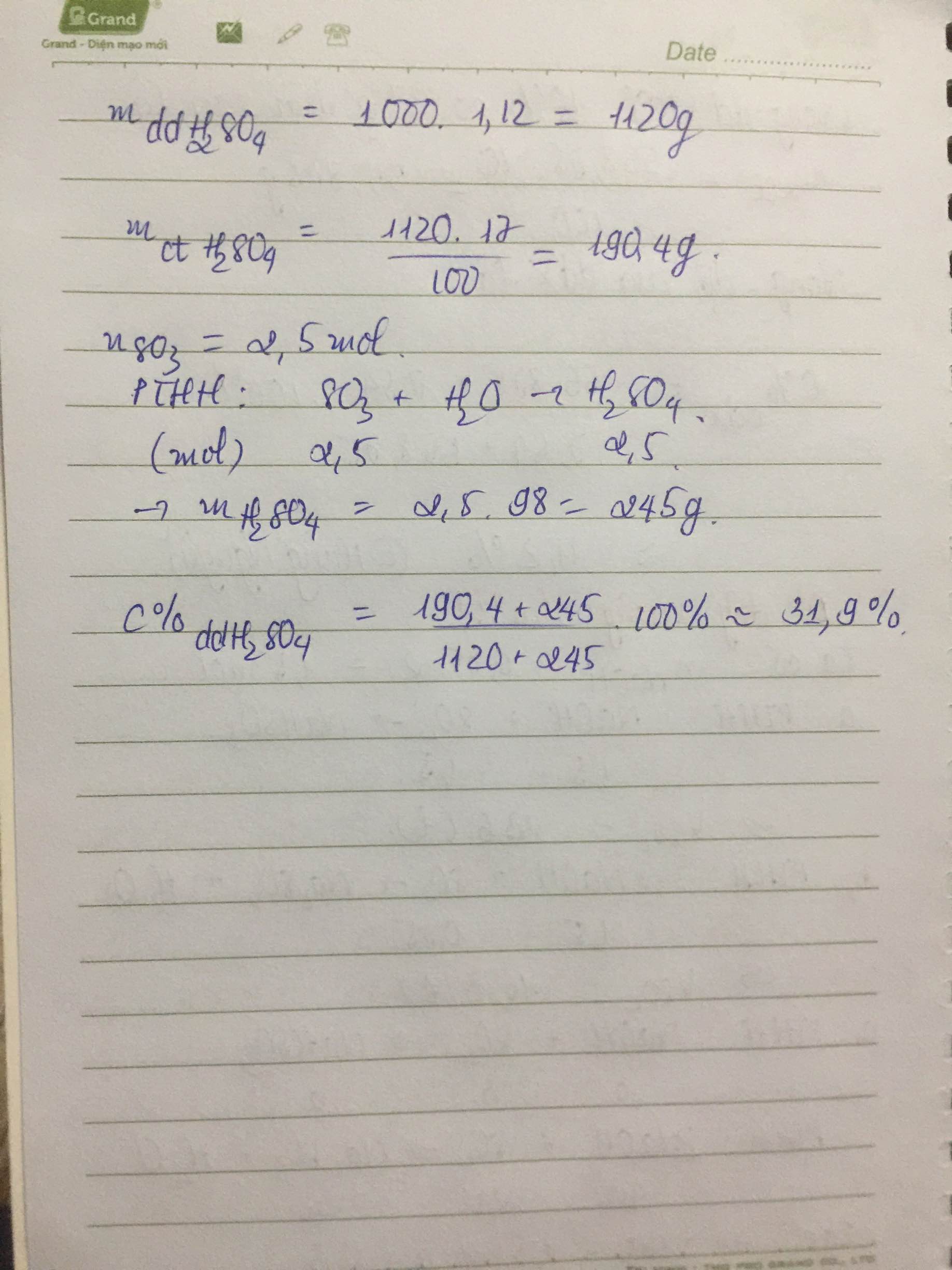Cho 80g SO3 vào 300g dd H2SO4 49% . Tính nồng độ phần trăm dd thu được.

Những câu hỏi liên quan
Hòa tan 24g Fe2O3 vào 300g dd H2SO4 19.6% sau pứng thu được dd A
A viết Pt phản ứng
B tính nồng độ phần trăm của dd A
hòa tan 40g Mgo vào 300g dd H2SO4 98%. Tính nồng độ phần trăm các chất trong dd sau phản ứng
PTHH: \(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{MgO}=\dfrac{40}{40}=1\left(mol\right)\\n_{H_2SO_4}=\dfrac{300\cdot98\%}{98}=3\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Axit còn dư
\(\Rightarrow\left\{{}\begin{matrix}n_{MgSO_4}=1\left(mol\right)\\n_{H_2SO_4\left(dư\right)}=2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}C\%_{MgSO_4}=\dfrac{120}{300+40}\cdot100\%\approx35,3\%\\C\%_{H_2SO_4\left(dư\right)}=\dfrac{2\cdot98}{300+40}\cdot100\%\approx57,65\%\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Lấy 10,2g Al2O3 cho vào 300g dd H2SO4 y% sau PƯ đc dd chứa muối sunfat và nước . tính giá trị y và nồng độ phần trăm của dd sau PƯ .
\(n_{Al_2O_3}=\dfrac{10,2}{102}=0,1(mol)\\ Al_2O_3+3H_2SO_4\to Al_2(SO_4)_3+3H_2O\\ \Rightarrow n_{H_2SO_4}=0,3(mol)n_{Al_2(SO_4)_3}=0,1(mol)\\ \Rightarrow C\%_{H_2SO_4}=\dfrac{0,3.98}{300}.100\%=9,8\%\\ \Rightarrow C\%_{Al_2(SO_4)_3}=\dfrac{0,1.342}{10,2+300}.100\%=11,03\%\)
Đúng 0
Bình luận (2)
Cho một lượng khí SO3 vào dd BaCl2 20% thu được 58,25g chất kết tủa màu trắng. Hỏi:
a. Tính thể tích khí SO3 phản ứng ( đktc)?
b. Tính nồng độ phần trăm của dd sau phản ứng?
\(n_{BaSO_4}=\dfrac{58.25}{233}=0.25\left(mol\right)\)
\(BaCl_2+SO_3+H_2O\rightarrow BaSO_4+2HCl\)
\(0.25........0.25.......................0.25........0.5\)
\(V_{SO_3}=0.25\cdot22.4=5.6\left(l\right)\)
\(m_{dd_{BaCl_2}}=\dfrac{0.25\cdot208}{20\%}=260\left(g\right)\)
\(m_{dd}=m_{SO_3}+m_{dd_{BaCl_2}}-m_{BaSO_4}=0.25\cdot80+260-58.25=221.75\left(g\right)\)
\(C\%_{HCl}=\dfrac{0.5\cdot36.5}{221.75}\cdot100\%=8.2\%\)
Đúng 4
Bình luận (0)
Hoà tan 120g h2so4 vào 80g h2o( biết khối lượng riêng của dd là 1.5g/mol) tính nồng độ mol của dd thu được
Trộn 200g SO3 vào 1 lít dd H2SO4 17% có KLR D= 1,12 g/ml. Tính nồng độ % của dd H2SO4 thu được
cho 2,4g Fe2O3 hòa tan trong 300g dd H2SO4 dư. tính nồng độ C% của muối dd thu được?
$m_{dd\ sau\ pư} = 2,4 + 300 = 302,4(gam)$
$Fe_2O_3 + 3H_2SO_4 \to Fe_2(SO_4)_3 + 3H_2O$
$n_{Fe_2(SO_4)_3} = n_{Fe_2O_3} = \dfrac{2,4}{160} = 0,015(mol)$
$C\%_{Fe_2(SO_4)_3} = \dfrac{0,015.400}{302,4}.100\% = 1,98\%$
Đúng 2
Bình luận (0)
Xác định nồng độ phần trăm của các dd trong các th sau :
a.Pha thêm 20g nước vào 80g dd muối ăn có nồng độ 15%
b.Trộn 200g dd muối ăn có nồng độ 20% với 300g dd muối ăn có nồng độ 5%
c.Trộn 100g dd NaOH a% với 50g dd NaOH 10% được dd NaOH 7.5%
a, mct = \(\dfrac{15\cdot80}{100}\)= 12 (g)
C% = \(\dfrac{12}{80+20}\)* 100 = 12%
b, áp dụng quy tắc đương chéo:
m1= 200g có C%=20%↓ C-5
C%➚
m2=300g có c% =5%➚ 20-C
ta có:
\(\dfrac{200}{300}\)=\(\dfrac{2}{3}\)=\(\dfrac{C-5}{20-C}\)⇒2.(20-C)=3.(C-5)
Giải pt ta được C=11%
Đúng 0
Bình luận (0)
a, mct = 15⋅80100= 12 (g)
C% = 1280+20* 100 = 12%
b, áp dụng quy tắc đương chéo:
m1= 200g có C%=20%↓ C-5
C%➚
m2=300g có c% =5%➚ 20-C
ta có:
200300=23=C−520−C⇒2.(20-C)=3.(C-5)
Giải pt ta được C=11%
Đúng 0
Bình luận (0)
Cho 10,8g Al vào 300g dd HCl 3,65%. Khi phản ứng xảy ra hoàn toàn thu đc dd X và V l khí H2(đktc). Tính V và nồng độ phần trăm của X
\(2Al + 6HCl \rightarrow 2AlCl_3 + 3H_2\)
\(n_{Al}= \dfrac{10,8}{27}=0,4 mol\)
\(n_{HCl}= 0,3 mol\)
\(2Al + 6HCl \rightarrow 2AlCl_3 + 3H_2\)
Trước PƯ: 0,4 0,3
PƯ: 0,1 0,3 0,1 0,15
Sau PƯ: 0,3 0 0,1 0,15
Đây là mình làm tắt, bạn nên làm bài hết dư này theo cách của bạn
Sau PƯ: dd X có AlCl3 (0,1 mol) và 0,15 mol H2
\(V= 0,15 . 22,4=3,36 l\)
\(m_{dd sau pư}= m_{Al pư} + m_{dd HCl} - m_{H_2}= 0,1 . 27 + 300 - 0,15. 2=302 , 4g\)
C% X=\(\dfrac{ 0,1 . 133,5}{302,4}\). 100%= 4,41%
Đúng 1
Bình luận (0)