Hóa tan 5,6 g một kim loại hóa trị 2 vào dung dich axitclohidric dư,thu được 2,24 l khí H2 (đktc).Xác định kim loại

Những câu hỏi liên quan
Hòa tan hoàn toàn 5,6 gam một kim loại X hóa trị II vào dung dịch axit clohiđric HCl, thu được 2,24 lít khí H2 (đktc). Xác định kim loại X:
A. Mg
B. Fe
C. Zn
D. Cu
Số mol của khí hidro ở dktc
nH2 =\(\dfrac{V_{H2}}{22,4}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Pt : X + 2HCl → XCl2 + H2\(|\)
1 2 1 1
0,1 0,1
Số mol của kim loại X
nX = \(\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
⇒ MX = \(\dfrac{m_X}{n_X}=\dfrac{5,6}{0,1}=56\) (dvc)
Vậy kim loại x là Fe
⇒ Chọn câu : B Chúc bạn học tốt
Đúng 2
Bình luận (0)
\(R+2HCl \rightarrow RCl_2+H_2\\ n_{H_2}=\frac{2,24}{22,4}=0,1mol\\ M_R=\frac{5,6}{0,1}=56 g/mol\\ \Rightarrow R: Fe\)
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 4g hỗn hợp X gồm Fe và kim loại hóa trị II vào dung dịch HCl dư thu được 2,24 lít khí H2 ở (đkt). Nếu dùng 2,4g kim loại hóa trị II hòa tan vào dung dịch HCl thì dùng không hết 0,5 mol dung dich HCl.
a. Xác định tên kim loại hóa trị II.
b. Tính thành phần % theo khối lượng của mỗi kim loại trong 4g hỗn hợp X
hòa tan 8,7 g một hỗn hợp gồ kal và một kim loại M hóa trị 2 trong dung dịch HCl dư thì thu được 5,6 lít khí h2 ở đktc . Hòa tan riên 9 g kl M trong dung dịch HCl dư thì theer tích H2 sinh ra ch đến 11 l khí H2 ở đktc . xác định kim loại M
Hòa tan hoàn toàn 4 gam hỗn hợp gồm Fe và một kim loại hóa trị II vào dung dịch HCl dư, thu được 2,24 lít khí H2 (đktc). Nếu chỉ dùng 2,4 gam kim loại hóa trị II thì sử dụng không hết 0,5 mol HCl. Xác định tên kim loại hóa trị II.
C1: Hòa tan hoàn toanf16,25g kim loại N chưa rõ hóa trị vào dung dịch HCl. Khi phản ứng kết thúc thu được 5,6(l) khí H2 (đktc)a) Xác định tên kim loại Nb) Tính thể tích dung dịch HCl cần dùng để hòa tan hết lượng kim loại trên.C2. Cho 8,1(g) Al tác dụng với dung dịch chứa 21,9(g) HCl.a) Sau phản ứng chất nào còn dư và khối lượng là bao nhiêu (g).b) Tính khối lượng sản phẩm tạo thành.c) Lượng khí H2 sinh ra có thể khử được bao nhiêu gam CuO.
Đọc tiếp
C1: Hòa tan hoàn toanf16,25g kim loại N chưa rõ hóa trị vào dung dịch HCl. Khi phản ứng kết thúc thu được 5,6(l) khí H2 (đktc)
a) Xác định tên kim loại N
b) Tính thể tích dung dịch HCl cần dùng để hòa tan hết lượng kim loại trên.
C2. Cho 8,1(g) Al tác dụng với dung dịch chứa 21,9(g) HCl.
a) Sau phản ứng chất nào còn dư và khối lượng là bao nhiêu (g).
b) Tính khối lượng sản phẩm tạo thành.
c) Lượng khí H2 sinh ra có thể khử được bao nhiêu gam CuO.
C2:
PTHH: 2Al+6HCl →2AlCl3 +3H2
a)
Ta có:
\(+n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
\(+n_{HCl}=\dfrac{21,9}{36,5}=0,6\left(mol\right)\)
Biện luận:
\(\dfrac{0,3}{2}>\dfrac{0,6}{6}\)
⇒Al dư, HCl pư hết.
\(+n_{Al}\)dư =0,3-0,2=0,1(mol
\(+m_{Al}\)dư =0,1.27=2,7(gam)
b)
\(+n_{AlCl_3}=0,2\left(mol\right)\)
⇒\(m_{AlCl_3}=0,2.133,5=26,7\left(gam\right)\)
c) PTHH: H2+CuO→Cu+H2O
\(+n_{CuO}=n_{H_2}=0,3\left(mol\right)\)
\(+m_{CuO}=0,3.80=24\left(gam\right)\)
Chúc bạn học tốt.
Đúng 2
Bình luận (0)
\(1.\)
\(n_{H_2}=\dfrac{5.6}{22.4}=0.25\left(mol\right)\)
\(2N+2nHCl\rightarrow2NCl_n+nH_2\)
\(\dfrac{0.5}{n}.....0.5...............0.25\)
\(M_N=\dfrac{16.25}{\dfrac{0.5}{n}}=32.5n\left(\dfrac{g}{mol}\right)\)
\(BL:n=2\Rightarrow N=65\)
\(Nlà:Zn\)
Không tính được thể tích vì thiếu nồng độ mol nhé.
\(2.\)
\(n_{Al}=\dfrac{8.1}{27}=0.3\left(mol\right)\)
\(n_{HCl}=\dfrac{21.9}{36.5}=0.6\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(0.2........0.6..........0.2...........0.3\)
\(m_{Al\left(dư\right)}=\left(0.3-0.2\right)\cdot27=2.7\left(g\right)\)
\(m_{AlCl_3}=0.2\cdot133.5=26.7\left(g\right)\)
\(CuO+H_2\underrightarrow{t^0}Cu+H_2O\)
\(0.3.....0.3\)
\(m_{CuO}=0.3\cdot80=24\left(g\right)\)
Đúng 2
Bình luận (2)
Câu 1:
a, Giả sử kim loại N có hóa trị n.
PT: \(2N+2nHCl\rightarrow2NCl_n+nH_2\)
Ta có: \(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Theo PT: \(n_N=\dfrac{2}{n}n_{H_2}=\dfrac{0,5}{n}\left(mol\right)\)
\(\Rightarrow M_N=\dfrac{16,25}{\dfrac{0,5}{n}}=32,5n\)
Với n = 1 ⇒ MN = 32,5 (loại)
Với n = 2 ⇒ MN = 65 (nhận)
Với n = 3 ⇒ MN = 97,5 (loại)
Vậy, N là kẽm (Zn).
b, Theo PT: \(n_{HCl}=2n_{H_2}=0,5\left(mol\right)\)
Phần này đề bài có cho thiếu nồng độ mol của dd HCl không bạn nhỉ?
Câu 2:
a, PT; \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Ta có: \(n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
\(n_{HCl}=\dfrac{21,9}{36,5}=0,6\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,3}{2}>\dfrac{0,6}{6}\), ta được Al dư.
Theo PT: \(n_{Al\left(pư\right)}=\dfrac{1}{3}n_{HCl}=0,2\left(mol\right)\)
\(\Rightarrow n_{Al\left(dư\right)}=0,1\left(mol\right)\Rightarrow m_{Al\left(dư\right)}=0,1.27=2,7\left(g\right)\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{AlCl_3}=\dfrac{1}{3}n_{HCl}=0,2\left(mol\right)\\n_{H_2}=\dfrac{1}{2}n_{HCl}=0,3\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{AlCl_3}=0,2.133,5=26,7\left(g\right)\\m_{H_2}=0,3.2=0,6\left(g\right)\end{matrix}\right.\)
c, PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Theo PT: \(n_{CuO}=n_{H_2}=0,3\left(mol\right)\)
\(\Rightarrow m_{CuO}=0,3.80=24\left(g\right)\)
Bạn tham khảo nhé!
Đúng 2
Bình luận (1)
Hòa tan 5,4g một kim loại hóa trị III vào dung dịch H2SO4 lượng dư. Sau p/ứ thu được 6,72 lít khí H2 (đktc). Xác định tên kim loại.
nH2 = 6.72/22.4 = 0.3 (mol)
2A + 3H2SO4 => A2(SO4)3 + 3H2
0.2______________________0.3
MA = 5.4/0.2 = 27
=> A là : Al
Đúng 3
Bình luận (0)
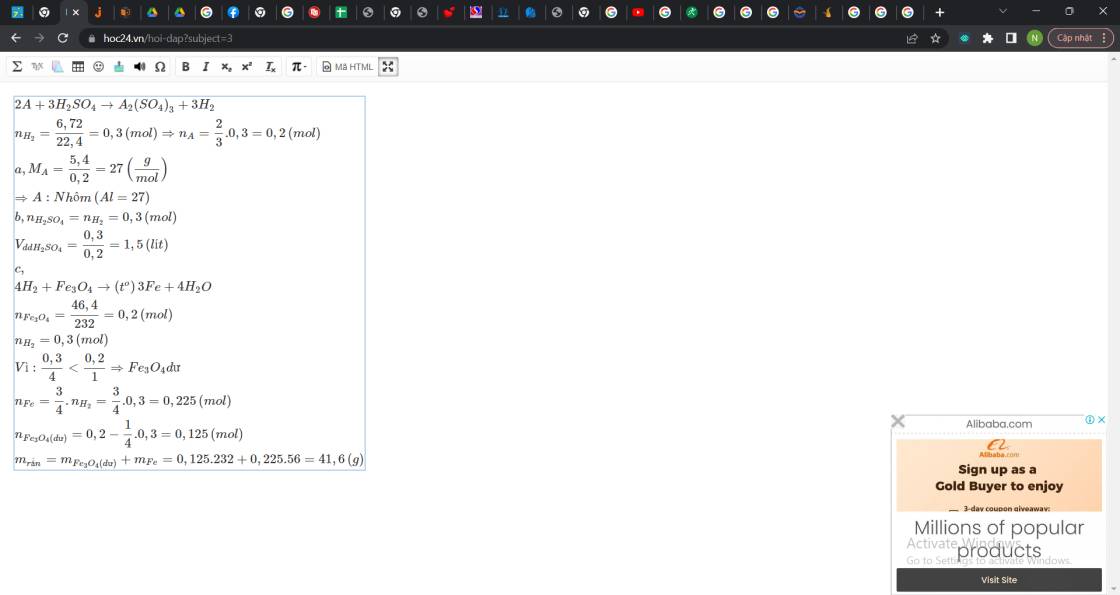
Hòa tan 5,4g một kim loại A hóa trị III vào dung dịch H2SO4 lượng dư. Sau p/ứ thu được 6,72 lít khí H2 (đktc). a) Xác định kim loại A b) tính thể tích dung dịch axit sunfuric 0,2M cần dùng cho phản ứng c) nếu dẫn lượng khí thu được ở phản ứng trên qua bình đựng 46,4g fe2o3. tính khối lượng chất rắn th...
Đọc tiếp
Hòa tan 5,4g một kim loại A hóa trị III vào dung dịch H2SO4 lượng dư. Sau p/ứ thu được 6,72 lít khí H2 (đktc). a) Xác định kim loại A b) tính thể tích dung dịch axit sunfuric 0,2M cần dùng cho phản ứng c) nếu dẫn lượng khí thu được ở phản ứng trên qua bình đựng 46,4g fe2o3. tính khối lượng chất rắn thu được sau phản ứng
\(2A+3H_2SO_4\rightarrow A_2\left(SO_4\right)_3+3H_2\\ n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\Rightarrow n_A=\dfrac{2}{3}.0,3=0,2\left(mol\right)\\ a,M_A=\dfrac{5,4}{0,2}=27\left(\dfrac{g}{mol}\right)\\ \Rightarrow A:Nhôm\left(Al=27\right)\\ b,n_{H_2SO_4}=n_{H_2}=0,3\left(mol\right)\\ V_{ddH_2SO_4}=\dfrac{0,3}{0,2}=1,5\left(lít\right)\\ c,\\ 3H_2+Fe_2O_3\rightarrow\left(t^o\right)2Fe+3H_2O\\ n_{Fe_3O_4}=\dfrac{46,4}{232}=0,2\left(mol\right)\\ n_{H_2}=0,3\left(mol\right)\\ Vì:\dfrac{0,3}{3}< \dfrac{0,2}{1}\Rightarrow Fe_3O_4dư\\ n_{Fe}=\dfrac{2}{3}.n_{H_2}=\dfrac{2}{3}.0,3=0,2\left(mol\right)\\ n_{Fe_3O_4\left(dư\right)}=0,2-\dfrac{1}{3}.0,3=0,1\left(mol\right)\\ m_{rắn}=m_{Fe_3O_4\left(dư\right)}+m_{Fe}=0,1.232+0,2.56=34,4\left(g\right)\)
Đúng 1
Bình luận (0)
Này mới đúng nè em!
Đúng 0
Bình luận (0)
Bài 24. Hòa tan 3,6g một kim loại A hóa trị II bằng một lượng dư axit HCl thu được 3,36 lít khí H2 (đktc). Xác định tên kim loại ABài 25. Hòa tan hoàn toàn 8,1g kim loại A hóa trị III trong dd HCl dư thu đucợ 10,08 lít khí H2 (đktc). Xác định tên A và m HCl đã dùng
Đọc tiếp
Bài 24. Hòa tan 3,6g một kim loại A hóa trị II bằng một lượng dư axit HCl thu được 3,36 lít khí H2 (đktc). Xác định tên kim loại A
Bài 25. Hòa tan hoàn toàn 8,1g kim loại A hóa trị III trong dd HCl dư thu đucợ 10,08 lít khí H2 (đktc). Xác định tên A và m HCl đã dùng
Bài 24:
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ PTHH:A+2HCl\rightarrow ACl_2+H_2\uparrow\)
Theo pthh: nA = nH2 = 0,15 (mol)
=> MA = \(\dfrac{3,6}{0,15}=24\left(\dfrac{g}{mol}\right)\)
=> A là Mg
Bài 25:
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\\ PTHH:2A+6HCl\rightarrow2ACl_3+3H_2\uparrow\\ Mol:0,3\leftarrow0,9\leftarrow0,3\leftarrow0,45\\ \rightarrow\left\{{}\begin{matrix}M_A=\dfrac{8,1}{0,3}=27\left(\dfrac{g}{mol}\right)\Rightarrow A:Al\\m_{HCl}=0,9.36,5=32,85\left(g\right)\end{matrix}\right.\)
Đúng 2
Bình luận (1)
Bài 24.
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(n_A=\dfrac{3,6}{M_A}\) mol
\(A+2HCl\rightarrow ACl_2+H_2\)
0,15 0,15 ( mol )
\(\Rightarrow\dfrac{3,6}{M_A}=0,15mol\)
\(\Leftrightarrow M_A=24\) ( g/mol )
=> A là Magie ( Mg )
Bài 25.
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45mol\)
\(n_A=\dfrac{8,1}{M_A}\) mol
\(2A+6HCl\rightarrow2ACl_3+3H_2\)
0,3 0,45 ( mol )
\(\Rightarrow\dfrac{8,1}{M_A}=0,3\)
\(\Leftrightarrow M_A=27\) g/mol
=> A là nhôm ( Al )
Đúng 1
Bình luận (0)
Câu 1. Cho 2g hỗn hợp 2 kim loại Fe là kim loại hóa trị II vào dung dịch HCl dư thì thu được 1,12l khí H2(ĐKTC). Mặt khác nếu hòa tan 4,8g kim loại hóa trị II đó thì cần chưa tới 500ml dung dịch HCl 1M. Xác định kim loại hóa trị II.
Giúp MK với!!!





























