hòa tan 4.88 g hỗn hợp gồm MgO và FeO trong 200ml dung dịch H2SO4 0.4 gam vừa đủ .tính kl mỗi oxits
Hòa tan 4,88g hỗn hợp A gồm MgO và FeO trong 200ml dung dịch H2SO4 0,45M(loãng) thì phản ứng vừa đủ, thu được dung dịch B. a, Tính khối lượng mỗi oxit có trong hỗn hợp A b, Để tác dụng vừa đủ với 2 muối trong dung dịch B cần dùng V(lit) dung dịch NaOH 0,2M, thu được kết tủa gồm 2 hiđrôxit kim loại. Lọc lấy kết tủa, đem nung trong không khí đến khối lượng không đổi thu được m gam chất rắn khan (phản ứng hoàn toàn). Tính V và m.
Hòa tan 4,88g hỗn hợp A gồm MgO và FeO trong 200ml dung dịch H²SO⁴ 0,45M(loãng) thì phản ứng vừa đủ. Tính % theo khối lượng mỗi oxit có trong hỗn hợp A.
PT: \(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
\(FeO+H_2SO_4\rightarrow FeSO_4+H_2O\)
Gọi: \(\left\{{}\begin{matrix}n_{MgO}=x\left(mol\right)\\n_{FeO}=y\left(mol\right)\end{matrix}\right.\) ⇒ 40x + 72y = 4,88 (1)
Ta có: \(n_{H_2SO_4}=0,2.0,45=0,09\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{MgO}+n_{FeO}=x+y=0,09\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,05\left(mol\right)\\y=0,04\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{MgO}=\dfrac{0,05.40}{4,88}.100\%\approx40,98\%\\\%m_{FeO}\approx59,02\%\end{matrix}\right.\)
Hòa tan 4,88 gam hỗn hợp A gồm MgO và FeO trong dung dịch loãng chứa 8,82 gam H2SO4 thì phản ứng vừa đủ, thu được dung dịch B. Phần trăm khối lượng của MgO trong A?
Đặt \(n_{MgO}=x(mol);n_{FeO}=y(mol)\)
\(\Rightarrow 40x+72y=4,88(1)\\ MgO+H_2SO_4\to MgSO_4+H_2O\\ FeO+H_2SO_4\to FeSO_4+H_2O\\\Rightarrow x+y=\dfrac{8,82}{98}=0,09(2)\\ (1)(2)\Rightarrow x=0,05(mol);y=0,04(mol)\\ \Rightarrow \%_{MgO}=\dfrac{0,05.40}{4,88}.100\%=40,98\%\)
Bài 2: Hoà tan 4,88g hỗn hợp A gồm MgO và FeO trong 200ml dung dịch H2SO4 0,45M(loãng) thì phản ứng vừa đủ, thu được dung dịch B.
a/ Tính khối lượng mỗi oxit có trong hỗn hợp A.
b/ Để tác dụng vừa đủ với 2 muối trong dung dịch B cần dùng V(lit) dung dịch NaOH 0,2M, thu được kết tủa gồm 2 hiđrôxit kim loại. Lọc lấy kết tủa, đem nung trong không khí đến khối lượng không đổi thu được m gam chất rắn khan(phản ứng hoàn toàn). Tính V và m
Hòa tan 4,88 gam hỗn hợp A gồm MgO và FeO trong 200 ml dung dịch H 2 S O 4 0,45M loãng thì phản ứng vừa đủ, thu được dung dịch B. Phần trăm khối lượng của MgO trong A là
A. 59,02%
B. 61,34%
C. 40,98%
D. 38,66%
Chọn C
Gọi số mol của MgO và FeO trong hỗn hợp A là x và y mol
Vì mA = mMgO + mFeO = 40x + 72y
→ 40x + 72y = 4,88 (1)
Phương trình hóa học:

: Hỗn hợp X gồm FeO, Al2O3, MgO. Lâý 61,2 gam hỗn hợp X chia làm 2 phần bằng nhau : Phần 1 : hoà tan vào 200ml dung dịch KOH 1M vừa đủ thu được chất rắn A. Phần 2 : hoà tan vào 500g dung dịch H2SO4 10,78% thu được dung dịch B có khối lượng là 529,6 gam.Cho V lít Ba(OH)2 0,5 M vào dd B thu được chất rắn C. Để C ngoài không khí thu được chất rắn D a. Tính % khối lượng mỗi oxit có trong hỗn hợp X. b. Tính C% ddB. c. Tính V để d có giá trị lớn nhất, nhỏ nhất
mn giúp e với ạ
e cảm ơn ạ
Hòa tan hết 16,0 gam hỗn hợp X gồm Mg, MgO, Fe và FeO trong dung dịch H2SO4 loãng (vừa đủ), thu được dung dịch chứa 49,6 gam muối. Nếu hòa tan hết 16,0 gam X trên cần dùng dung dịch chứa xmol HCl và y mol H2SO4, thu được 6,72 lít khí H2 (đktc) và dung dịch chứa 45,6 gam muối. Tỉ lệ của x : y là
A. 8:5
B. 2:3
C. 4:5
D. 5:3
Chọn đáp án A.
Đặt nMg = a, nFe = b và nO = c
Ta có:
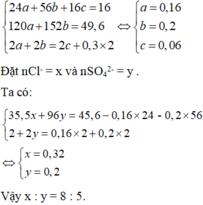
Có một hỗn hợp M gồm MgCO3, FeCO3, MgO, FeO trong đó số mol mỗi muối cacbonat bằng số mol oxit kim loại tương ứng. Đem hòa tan hết hỗn hợp M trong dung dịch H2SO4 9,8% vừa đủ thì thu được dung dịch Y có nồng độ % của dung dịch FeSO4 5,775%. Nồng độ % MgSO4 trong dung dịch Y?
Hòa tan hoàn toàn 2,81(g) hỗn hợp gồm Fe203, MgO, ZnO trong 500(ml) dung dịch H2SO4 0,1M (vừa đủ). Sau phản ứng thu được m(g) hỗn hợp muối sunfat. Tính m
\(n_{H_2SO_4}=0,5.0,1=0,05\left(mol\right)\Rightarrow n_{H_2O}=0,05\left(mol\right)\)
Theo ĐLBTKL: \(m_{oxit}+m_{H_2SO_4}=m_{muối}+m_{H_2O}\)
=> \(2,81+0,05.98=m+0,05.18\)
=> m = 6,81 (g)