a) Lấy chính xác 100ml dd H2SO4 0,2M và cho nước cất đến vạch 250ml. Tính nồng độ đương lượng của dung dịch mới và số gam H2SO4 có trong 10 ml dung dịch này. b) Tính nồng độ dung dịch HNO3 thu được khi trộn: • 500 g HNO3 10 % với 300 g HNO3 20% • 600 ml HNO3 2 N với 200 ml HNO3 4 N

Những câu hỏi liên quan
Lấy 5 ml dung dịch H2SO4 đậm đặc 98%, d = 1,84 g/ml cho vào 495 ml nước cất ta được dung dịch A .Tính nồng độ đương lượng của dung dịch HCl trong A
A.0,148N
B.0,841N
C.0,184N
D.0,118N
Để thu được 500 ml dung dịch H2SO4 2M cần lấy m gam H2SO4 đặc 98% (D = 1,87 gam/ml) và V ml nước cất. Coi quá trình pha loãng không làm thay đổi thể tích chất lỏng. a. Tính giá trị của m, V và nồng độ phần trăm của dung dịch H2SO4 2M thu được ở trên. b. Trình bày cách pha loãng để thu được dung dịch H2SO4 2M ở trên.
Trộn 100 ml dung dịch hỗn hợp HCl 0,2M và H2SO4 0,2M với 300 ml dung dịch NaOH 0,4 M thu được dung dịch (X) a/ Tính nồng độ các ion trong dung dịch (X) b/ Tính pH của dung dịch (X)
Đọc tiếp
Trộn 100 ml dung dịch hỗn hợp HCl 0,2M và H2SO4 0,2M với 300 ml dung dịch NaOH 0,4 M thu được dung dịch (X)
a/ Tính nồng độ các ion trong dung dịch (X)
b/ Tính pH của dung dịch (X)a, \(n_{HCl}=0,1.0,2=0,02\left(mol\right)=n_{H^+}=n_{Cl^-}\)
\(n_{H_2SO_4}=0,1.0,2=0,02\left(mol\right)=n_{SO_4^{2-}}\) \(\Rightarrow n_{H^+}=2n_{H_2SO_4}=0,04\left(mol\right)\)
\(n_{NaOH}=0,3.0,4=0,12\left(mol\right)=n_{Na^+}=n_{OH^-}\)
\(\Rightarrow\sum n_{H^+}=0,02+0,04=0,06\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
0,06__0,06 (mol)
⇒ nOH- dư = 0,12 - 0,06 = 0,06 (mol)
\(\Rightarrow\left\{{}\begin{matrix}\left[Cl^-\right]=\dfrac{0,02}{0,1+0,3}=0,05\left(M\right)\\\left[SO_4^{2-}\right]=\dfrac{0,02}{0,1+0,3}=0,05\left(M\right)\\\left[Na^+\right]=\dfrac{0,12}{0,1+0,3}=0,3\left(M\right)\\\left[OH^-\right]=\dfrac{0,06}{0,1+0,3}=0,15\left(M\right)\end{matrix}\right.\)
b, pH = 14 - (-log[OH-]) ≃ 13,176
Đúng 2
Bình luận (0)
Cân lấy 10,6 gam
Na
2
CO
3
cho vào cốc chia độ có dung tích 500ml. Rót từ từ nước cất vào cốc cho đến vạch 200ml. Khuấy nhẹ cho
Na
2
CO
3
tan hết, ta được dung dịch
Na
2
CO
3
. Biết 1ml dung dịch này cho khối lượng là 1,05 gam. Hãy xác định nồng độ phần trăm (C%) và nồng độ mol của dung dịch vừa pha chế được.
Đọc tiếp
Cân lấy 10,6 gam Na 2 CO 3 cho vào cốc chia độ có dung tích 500ml. Rót từ từ nước cất vào cốc cho đến vạch 200ml. Khuấy nhẹ cho Na 2 CO 3 tan hết, ta được dung dịch Na 2 CO 3 . Biết 1ml dung dịch này cho khối lượng là 1,05 gam. Hãy xác định nồng độ phần trăm (C%) và nồng độ mol của dung dịch vừa pha chế được.
1ml dung dịch cho khối lượng 1,05 gam
200 ml dung dịch cho khối lượng m dd = 210 gam
Nồng độ phần trăm:
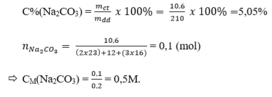
Đúng 0
Bình luận (0)
Cân lấy 10,6 gam
Na
2
CO
3
cho vào cốc chia độ có dung tích 500ml. Rót từ từ nước cất vào cốc cho đến vạch 200ml. Khuấy nhẹ cho
Na
2
CO
3
tan hết, ta được dung dịch
Na
2
CO
3
. Biết 1ml dung dịch này cho khối lượng là 1,05 gam. Hãy xác định nồng độ phần trăm (C%) và nồng độ mol của dung dịch vừa pha chế được
Đọc tiếp
Cân lấy 10,6 gam Na 2 CO 3 cho vào cốc chia độ có dung tích 500ml. Rót từ từ nước cất vào cốc cho đến vạch 200ml. Khuấy nhẹ cho Na 2 CO 3 tan hết, ta được dung dịch Na 2 CO 3 . Biết 1ml dung dịch này cho khối lượng là 1,05 gam. Hãy xác định nồng độ phần trăm (C%) và nồng độ mol của dung dịch vừa pha chế được
1ml dung dịch cho khối lượng 1,05 gam
200 ml dung dịch cho khối lượng mdd = 210 gam
Nồng độ phần trăm:
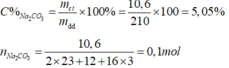
C M Na 2 CO 3 = 0 , 1 : 0 , 2 = 0 , 5 M .
Đúng 0
Bình luận (0)
38. Cho 4,8g Mg tác dụng với 250ml dd H2SO4 10%(d= 1,176g/ml) thu được khí H2 và dd A.
a. Tính thể tích khí H2(đkc) thu được. b. Tính nồng độ % các chất trong dung dịch A.
Ta có: nMg = 4,8 : 24 = 0,2 mol
a)PTHH:
Mg + H2SO4 → MgSO4 + H2
Theo tỉ lệ phản ứng => nH2SO4 phản ứng = nMgSO4 = nH2 = 0,2 mol
=> VH2 = 0,2.22,4 = 4,48 lít.
Đúng 1
Bình luận (0)
Bài 38 :
\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
\(m_{dd}=1,176.250=294\left(g\right)\)
\(m_{ct}=\dfrac{294.10}{100}=29,4\left(g\right)\)
\(n_{H2SO4}=\dfrac{29,4}{98}=0,3\left(mol\right)\)
Pt : \(Mg+H_2SO_4\rightarrow MgSO_4+H_2|\)
1 1 1 1
0,2 0,3 0,2 0,2
a) Lập tỉ số so sánh : \(\dfrac{0,2}{1}< \dfrac{0,3}{1}\)
⇒ Mg phản ứng hết , H2SO4 dư
⇒ Tính toán dựa vào số mol của Mg
\(n_{H2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,2.22,4=4,48\left(l\right)\)
b) \(n_{MgSO4}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{MgSO4}=0,2.120=24\left(g\right)\)
\(n_{H2SO4\left(dư\right)}=0,3-0,2=0,1\left(mol\right)\)
⇒ \(m_{H2SO4\left(dư\right)}=0,1.98=9,8\left(g\right)\)
Sau phản ứng :
\(m_{dd}=4,8+294-\left(0,2.2\right)=298,4\left(g\right)\)
\(C_{MgSO4}=\dfrac{24.100}{298,4}=8,04\)0/0
\(C_{H2SO4\left(dư\right)}=\dfrac{9,8.100}{298,4}=3,28\)0/0
Chúc bạn học tốt
Đúng 2
Bình luận (0)
\(a.n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\\ m_{ddH_2SO_4}=250.1,176=294\left(g\right)\\ n_{H_2SO_4}=\dfrac{294.10\%}{98}=0,3\left(mol\right)\\ Mg+H_2SO_4\rightarrow MgSO_4+H_2\\ Vì:\dfrac{0,3}{1}>\dfrac{0,2}{1}\\ \rightarrow H_2SO_4dư\\ n_{H_2}=n_{H_2SO_4\left(p.ứ\right)}=n_{MgSO_4}=n_{Mg}=0,2\left(mol\right)\\ n_{H_2SO_4\left(dư\right)}=0,3-0,2=0,1\left(mol\right)\\V_{H_2\left(đktc\right)}=0,2.22,4=4,48\left(l\right)\\ b.m_{ddsau}=4,8+294-0,2.2=298,4\left(g\right)\\ C\%_{ddMgSO_4}=\dfrac{0,2.120}{298,4}.100\approx8,043\%\)
\(C\%_{ddH_2SO_4\left(dư\right)}=\dfrac{0,1.98}{298,4}.100\approx3,284\%\)
Đúng 1
Bình luận (1)
Tính nồng độ mol/l các ion trong mỗi dd sau:
a) 100ml dd chứa 4,26 gam Al(NO3)3.
b) Tính nồng độ mol của ion Na+ trong dung dịch chứa NaNO3 0,1M,
Na2SO4 0,02M và NaCl 0,3M.
c) Dung dịch H2SO4 15% ( d= 1,1g/ml)
a) Ta có: \(n_{Al\left(NO_3\right)_3}=\dfrac{4,26}{213}=0,02\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}n_{Al^+}=0,02\left(mol\right)\\n_{NO_3^-}=0,06\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\left[Al^+\right]=\dfrac{0,02}{0,1}=0,2\left(M\right)\\\left[NO_3^-\right]=\dfrac{0,06}{0,1}=0,6\left(M\right)\end{matrix}\right.\)
b) Ta có: \(\left[Na^+\right]=0,1+0,02\cdot2+0,3=0,304\left(M\right)\)
c) Bạn xem lại đề !!
Đúng 0
Bình luận (0)
a,tính khối lượng NaOH có trong 200ml dung dịch NaOh 1M b,tính số mol H2SO4 có trong 100ml dung dịch H2SO4 2M c,hoà tan 6g NaCl vào nước thu được 200g dung dịch tính nồng độ phần trăm của dung dịch d,tính khối lượng NaCl có trong 200g dung dịch NaCl 8%
a, \(n_{NaOH}=0,2.1=0,2\left(mol\right)\)
\(m_{NaOH}=0,2.40=8\left(g\right)\)
b, \(n_{H_2SO_4}=2.0,1=0,2\left(mol\right)\)
\(c,C\%=\dfrac{6}{200}.100\%=3\%\)
\(m_{NaCl}=\dfrac{200.8}{100}=16\left(g\right)\)
Đúng 1
Bình luận (0)
Câu1 Trộn 100 ml dung dịch chứa HCl 0,1M và H2SO4 0,05M với 150 ml dung dịch Ba(OH)2 có nồng độ 0,15 M thu được 250 ml dung dịch có pH= x và m gam kết tủa. Giá trị của x và m là Câu2 Cho 10ml dung dịch HNO3 có pH=4. Cần thêm bao nhiêu ml nước cất để thu được dung dịch có pH=6?A. 990 ml. Câu3 Một dung dịch chứa 0,01 mol Na+; 0,02 mol SO42-; 0,01 mol Cl- và x mol Cu2+. Giá trị của x là






















