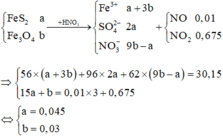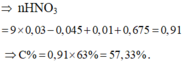Bài 8: Hòa tan muối RCO3 trong lượng vừa đủ dung dịch HNO3 20% thu được dung dịch có nồng độ muối là 26,582%. Tìm CTHH của muối cacbonat đã dùng.

Những câu hỏi liên quan
help me ...
Hòa tan hoàn toàn 1 lượng muối cacbonat của 1 kim loại chưa rõ hóa trị bằng một lượng vừa đủ dung dịch H2SO4 1,25% , sau phản ứng thu được dung dịch có nồng độ 17,31%. Tìm CTHH của muối cabonat.
Hòa tan muối cacbonat của kim loại M bằng 1 lượng vừa đủ dung dịch H2SO4 9.8% thu được muối sunfat có nồng độ 14.18%. Tìm kim loại M
gọi công thức của muối đó là M2(CO3)x với x là hóa trị của kim loại đó
gọi a là số mol của muối đó
M2(CO3)x + xH2SO4 ---> M2(SO4)x + xH2O + xCO2
a mol --- --- ->ax mol --- -->a mol --- --- --- --- --->ax mol
khối lượng H2SO4 tham gia phản ứng là 98ax gam
=> khối lượng dd H2SO4 là 1000ax gam
khối lượng muối cacbonat là a(2M + 60x) gam
khối lượng muối sunfat là a(2M + 96x) gam
khối lượng khí CO2 bay ra là 44ax gam
theo định luật bảo toàn khối lượng, ta có:
khối lượng dd sau phản ứng là
m = a(2M + 60x) + 1000ax - 44ax = 2aM + 1016ax
theo đề ta có:
(2aM + 96ax)/(2aM + 1016ax) = 14,18/100
triệt tiêu a ở vế trái, quy đồng 2 vế rồi biến đổi ta tính được:
M = 28x
kim loại chỉ có 3 hóa trị từ 1 đến 3
ta thay x lần lượt bằng 1, 2, 3 thì ra được kết quả thích hợp là:
x = 2 và M = 56
=> kim loại đó là Fe
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn hỗn hợp gồm FeS2 và Fe3O4 bằng 100 gam dung dịch HNO3 vừa đủ thu được 15,344 lít hỗn hợp khí gồm NO và NO2 có khối lượng 31,35 gam và dung dịch chỉ chứa 30,15 gam hỗn hợp 2 muối
F
e
3
+
trung hòa. Nồng độ dung dịch HNO3 đã dùng là A. 57,33% B. 63,00% C. 46,24% D. 43,12%
Đọc tiếp
Hòa tan hoàn toàn hỗn hợp gồm FeS2 và Fe3O4 bằng 100 gam dung dịch HNO3 vừa đủ thu được 15,344 lít hỗn hợp khí gồm NO và NO2 có khối lượng 31,35 gam và dung dịch chỉ chứa 30,15 gam hỗn hợp 2 muối F e 3 + trung hòa. Nồng độ dung dịch HNO3 đã dùng là
A. 57,33%
B. 63,00%
C. 46,24%
D. 43,12%
Hòa tan hoàn toàn m gam muối cacbonat của kim loại M (hóa trị II) bằng lượng vừa đủ HCl 7,3%, thu được dung dịch muối có nồng độ phần trăm bằng 9,135%. Xác định công thức của muối.
Giả sử có 1 mol RCO3
PTHH: RCO3 + 2HCl → RCl2 + CO2↑ + H2O
1 → 2 1 1 1 (mol)
Ta có mdd(sau pứ) = mRCO3+mdd(HCl)−mCO2
⟹ mdd(sau pứ) = \(\dfrac{\text{MR+60+(2.36,5.100%)}}{7,3\%-1,44}\)=MR+1016
⟹ C%(RCl2)=mRCl2mdd(sau).100%=\(\dfrac{M_{R_{ }}+71}{_{ }M_R+1016}\).100%=9,135%
⟹ MR = 24 (Mg)
Vậy công thức của muối là MgCO3.
Đúng 3
Bình luận (1)
Giải giúp em bài này với ạ!
Hòa tan 2g muối cacbonat của kim loại hóa trị II bằng dung dịch HCl 10% vừa đủ thu được 448cm3 chất khí ở đktc
a/ Tính mddHCl
b/ xác định CTHH của muối
c/ tính nồng độ phần trăm của chất tan trong dung dịch
gọi công thức muối là ACO3
n CO2=0,448:22,4=0,02mol
PTHH: ACO3+2HCl=>ACl2+CO2+H2O
0,02<--0,04<-0,02<-0,02->0,02
=> mHCl=0,04.36,5=1,46g
=> mddHCl=\(\frac{1,46}{10}.100=14,6g\)
ta có MACO3=2:0,02=100g/mol
=> M A=100-12-16.3=40
=> A là Ca
=> công thức muois là CACO3
ta có m CaCl2=0,02.111=2,22g
=> mddCaCl2=2+14,6-0,02.44-0,02.18=15,36g
=> C% CaCl2=2,22:15,36.100=14,45%
Đúng 0
Bình luận (3)
448 cm3 = 0,448 l
Gọi CTHH của muối cacbonat cần tìm là MCO3
MCO3 + 2HCl = MCl2 + CO2 + H2O
=> Khí thu được là CO2
Số mol CO2 là : 4,48 : 22,4 = 0,2 (mol)
Khối lượng CO2 là: 0,2 x 44 = 8,8 (g)
Theo PTHH: nHCl = 2 nCO2 = 0,2 x 2= 0,4 (mol)
Khối lượng HCl là: 0,4 x 36,5 = 14,6 (g)
Khối lượng dd HCl là : 14,6 : 10 x 100 = 146 (g)
Theo PTHH: nMCO3 = nCO2 = 0,2 (mol)
Khối lượng mol của MCO3 là: 20 : 0,2 = 100 (g)
Khối lượng mol của M: 100- 60 = 40 (g)
=> M là kim loại Ca
=> Muối cần tìm là CaCO3
Chất tan trong dung dịch là CaCl2
Theo PTHH: nCaCl2 = nCO2 = 0,2 (mol)
Khối lượng CaCl2 là : 111 x 0,2 = 22,2 (g)
Khối lượng dd mới là: 20 + 146 - 8,8 = 157,2 (g)
C% dd CaCl2 là: 22,2 :157,2 x 100 = 14,122%
Bạn ơi hình như bạn ghi sai đề, mk nghĩ muối cacbonat là 20g, không thể 2g được, bạn tham khảo nha
Đúng 0
Bình luận (4)
Hòa tan một muối cacbonat kim loại hóa trị 2 bằng một lượng vừa đủ H2 SO4 20% thu được dung dịch muối có nồng độ24,91% .xác định Cthh của muối
Gọi CTHH của muối cacbonat là MCO3
MCO3 + H2SO4 → MSO4 + CO2 + H2O
Gọi x là số mol của MCO3
\(\Rightarrow m_{MCO_3}=xM_M+60x\left(g\right)\)
Theo PT: \(n_{H_2SO_4}=n_{MCO_3}=x\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=98x\left(g\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\frac{98x}{20\%}=490x\left(g\right)\)
Theo PT: \(n_{CO_2}=n_{MCO_3}=x\left(mol\right)\)
\(\Rightarrow m_{CO_2}=44x\left(g\right)\)
Ta có: \(m_{dd}saupứ=xM_M+60x+490x-44x=xM_M+506x\left(g\right)\)
Theo PT: \(n_{MSO_4}=n_{MCO_3}=x\left(mol\right)\)
\(\Rightarrow m_{MSO_4}=xM_M+96x\left(g\right)\)
\(C\%_{MSO_4}=\frac{xM_M+96x}{xM_M+506x}\times100\%=24,91\%\)
\(\Leftrightarrow\frac{M_M+96}{M_M+506}=0,2491\)
\(\Rightarrow M_M+96=0,2491M_M+126,0446\)
\(\Leftrightarrow0,7509M_M=30,0446\)
\(\Leftrightarrow M_M=40\left(g\right)\)
Vậy M là Canxi Ca
CTHH của muối cacbonat là CaCO3
Đúng 0
Bình luận (0)
Gọi: CTHH của muối cacbonat là : MCO3 ( x mol )
MCO3 + H2SO4 --> MSO4 + CO2 + H2O
x________x_________x______x
mMCO3 = x ( M +60 ) (g)
mH2SO4 = 98x g
mdd H2SO4 = 98x*100/20=490x (g)
mCO2 = 44x g
mdd sau phản ứng = x(M+60) + 490x - 44x = x ( M+506) (g)
mMSO4 = x ( M + 96 ) (g)
Ta có : \(C\%MSO_4=\frac{x\left(M+96\right)}{x\left(M+506\right)}\cdot100\%=24.91\%\)
\(\Leftrightarrow M+96=0.2491\left(M+506\right)\)
\(\Leftrightarrow M+96=0.2491M+126.0446\)
\(\Leftrightarrow0.7509M=30.0446\)
\(\Leftrightarrow M\approx40\left(Ca\right)\)
Vậy: CTHH của muối cacbonat là : CaCO3
Đúng 0
Bình luận (0)
hoà tan một muối cacbonat của kim loại R ( chưa biết hoá trị ) trong một lượng vừa đủ dung dịch H2SO4 12,25% thu được dung dịch muối sunfat của kim loại R có nồng độ 17,431%. Xác định kim loại R
tham khảo
Coi mdd H2SO4=100(gam)mdd H2SO4=100(gam)
nR2(SO4)n=nR2(CO3)n=nH2SO4n=0,1n(mol)nR2(SO4)n=nR2(CO3)n=nH2SO4n=0,1n(mol)
Sau phản ứng ,
mR2(SO4)n=0,1n(2R+96n)=0,2Rn+9,6(gam)mR2(SO4)n=0,1n(2R+96n)=0,2Rn+9,6(gam)
Đúng 0
Bình luận (0)
Câu 8: Hòa tan hoàn toàn hỗn hợp X gồm Fe và Mg bằng một lượng vừa đủ dung dịch HCl 20% thu được dung dịch Y. Biết nồng độ của MgCl2 trong dung dịch Y là 11,787%. a) Viết phương trình phản ứng? b) Tính nồng độ % của muối sắt trong dung dịch Y?
\(a.Mg+2HCl->MgCl_2+H_2\\ Fe+2HCl->FeCl_2+H_2\\ b.Giả.sử:có:100g.dd.HCl\\ n_{HCl}=\dfrac{20\%.100}{36,5}=\dfrac{40}{73}mol\\ n_{Fe}=a;n_{Mg}=b\\ 2a+2b=\dfrac{40}{73}\\ BTKL:m_{ddsau}=56a+24b+100-2\left(a+b\right)=54a+22b+100\left(g\right)\\ C\%_{MgCl_2}=\dfrac{95b}{54a+22b+100}=\dfrac{11,787}{100}\\ -54a+783,97b=100\\ a=b=0,137\left(mol\right)\\ C\%FeCl_2=\dfrac{0,137\cdot127}{\dfrac{95\cdot0,137}{11,787\%}}\cdot100\%=15,757\%\)
Đúng 2
Bình luận (0)
Hòa tan hết m gam hỗn hợp Fe, Zn bằng dung dịch H2SO4 10% vừa đủ, thu được dung dịch có nồng độ phần trăm của muối sắt là 4,87%. Nồng độ phần trăm của muối kẽm trong dung dịch là: A. 10,32% B. 8,72% C. 10,95% D. 10,30%
Đọc tiếp
Hòa tan hết m gam hỗn hợp Fe, Zn bằng dung dịch H2SO4 10% vừa đủ, thu được dung dịch có nồng độ phần trăm của muối sắt là 4,87%. Nồng độ phần trăm của muối kẽm trong dung dịch là:
A. 10,32%
B. 8,72%
C. 10,95%
D. 10,30%
Đặt nFe = x,nZn = y.
Khối lượng dung dịch sau phản ứng là 56x+65y+980(x+y) - 2(x+y) = 1034x+1043y
%khối lượng muối sắt = 152x/(1034x+1043y)
=> y=2x
=> % khối lượng muối kẽm = 161y/(1034x+1043y) = 10,32%
=> Đáp án A
Đúng 0
Bình luận (0)