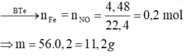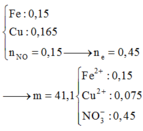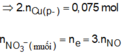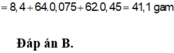pu của fe du vs o,04 hno3 loãng thấy xuất hiện khi No tính m thu được

Những câu hỏi liên quan
Câu 01. Hòa tan 5,6 gam kim loại Fe vào dung dịch HNO3 1M loãng dư, sau phản ứng thu được Fe(NO3)3, NO và H2O. Tính thể tích tối thiểu của dung dịch HNO3 đã dùng.
giup em vs ạ
cho 11,2 gam fe tác dụng với HNO3 loãng dư thu được V lít khí NO (đktc). a) tính giá trị của V. b) cô cạn dung dịch thu được sau phản ứng thu được m gam muối. Tính giá trị của m
a) $n_{Fe} = \dfrac{11,2}{56} = 0,2(mol)$
$Fe^0 \to Fe^{+3} + 3e$
$N^{+5} + 3e \to N^{+2}$
Bảo toàn electron : $3n_{Fe} = 3n_{NO}$
$\Rightarrow n_{NO} = 0,2(mol)$
$\Rightarrow V = 0,2.22,4 = 4,48(lít)$
b) $n_{Fe(NO_3)_3} = n_{Fe} = 0,2(mol)$
$\Rightarrow m = 0,2.242 = 48,4(gam)$
Đúng 1
Bình luận (0)
hòa tan hoàn toàn 6,72 gam Fe trong dung dịch HNO3 loãng dư. Sau khi phản ứng kết thúc thu được V ml khí NO duy nhất đktc. Tính giá trị của V (cho Fe = 56)
\(Fe+4HNO_3\rightarrow Fe\left(NO_3\right)_3+NO+2H_2O\\ n_{Fe}=\dfrac{6,72}{56}=0,12\left(mol\right)=n_{NO}\\V= V_{NO\left(đktc\right)}=0,12.22,4=2,688\left(l\right)=2668\left(ml\right)\)
Đúng 1
Bình luận (0)
Câu 5: Cho 11 gam hỗn hợp hai kim loại Al, Fe vào dung dịch HNO3 loãng, du thu được 6,72 lít khí NO(đktc) duy nhất. Khối lượng (g) của Al và Fe trong hỗn hợp đầu là?
Theo gt ta có: $n_{NO}=0,3(mol)$
Gọi số mol của Al và Fe trong 11g hỗn hợp lần lượt là a;b(mol)
Ta có: \(\left\{{}\begin{matrix}27a+56b=11\\3a+3b=0,9\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\)
Suy ra $m_{Fe}=5,4(g);m_{Al}=5,6(g)$
Đúng 1
Bình luận (0)
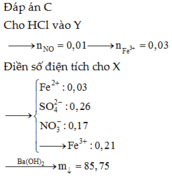
Hòa tan hết hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4, Fe(OH)2 và Fe(OH)3 trong dung dịch chứa 0,26 mol H2SO4 và 0,22 mol HNO3, thu được dung dịch X (chỉ chứa muối) và 0,05 mol khí NO (spkdn). Cho HCl dư vào X lại thấy có 0,01 mol NO thoát ra. Mặt khác, cho Ba(OH)2 dư vào X thấy xuất hiện m gam kết tủa. Giá trị của m là? A. 78,95 B. 98,34 C. 85,75 D. 82,35
Đọc tiếp
Hòa tan hết hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4, Fe(OH)2 và Fe(OH)3 trong dung dịch chứa 0,26 mol H2SO4 và 0,22 mol HNO3, thu được dung dịch X (chỉ chứa muối) và 0,05 mol khí NO (spkdn). Cho HCl dư vào X lại thấy có 0,01 mol NO thoát ra. Mặt khác, cho Ba(OH)2 dư vào X thấy xuất hiện m gam kết tủa. Giá trị của m là?
A. 78,95
B. 98,34
C. 85,75
D. 82,35
cho m gam fe vào dung dịch hno3 loãng. sau khi phản ứng xảy ra hoàn toàn thu được 3.136l NO (sản phẩm khử duy nhất ở đktc) và dd X gồm 2 muối trong đó khối lượng fe(no3)3 là 2.7m g . tính m
\(n_{NO} = \dfrac{3,136}{22,4}= 0,14\ mol\ ;\ n_{Fe(NO_3)_3} = \dfrac{2,7m}{242} (mol)\\ \Rightarrow n_{Fe(NO_3)_2} = \dfrac{m}{56} - \dfrac{2,57m}{242}(mol)\\ BT\ e\ : 2(\dfrac{m}{56} - \dfrac{2,7m}{242}) + 3.\dfrac{2,7m}{242} = 0,14.3\\ \Rightarrow m = 8,96\ gam\)
Đúng 1
Bình luận (0)
Hòa tan m gam Fe vào dung dịch HNO3 loãng, dư thu được 4,48 lít khí NO duy nhất (đktc). Giá trị của m là: A. 0,56 gam B. 11,2 gam C. 1,12 gam D. 5,6 gam
Đọc tiếp
Hòa tan m gam Fe vào dung dịch HNO3 loãng, dư thu được 4,48 lít khí NO duy nhất (đktc). Giá trị của m là:
A. 0,56 gam
B. 11,2 gam
C. 1,12 gam
D. 5,6 gam
Cho hỗn hợp gồm 8,40 gam Fe và 10,56 gam Cu vào dung dịch HNO3 loãng, kết thúc phản ứng thấy thoát ra 0,15 mol khí NO (sản phẩm khử duy nhất của N+5); đồng thời thu được dung dịch chứa m gam muối. Giá trị m là A. 65,46 gam B. 41,10 gam C. 58,02 gam D. 46,86 gam
Đọc tiếp
Cho hỗn hợp gồm 8,40 gam Fe và 10,56 gam Cu vào dung dịch HNO3 loãng, kết thúc phản ứng thấy thoát ra 0,15 mol khí NO (sản phẩm khử duy nhất của N+5); đồng thời thu được dung dịch chứa m gam muối. Giá trị m là
A. 65,46 gam
B. 41,10 gam
C. 58,02 gam
D. 46,86 gam
Cho hỗn hợp gồm 8,40 gam Fe và 10,56 gam Cu vào dung dịch HNO3 loãng, kết thúc phản ứng thấy thoát ra 0,15 mol khí NO (sản phẩm khử duy nhất của N+5), đồng thời thu được dung dịch chứa m gam muối. Giá trị của m là: A.65,46. B. 41,10. C. 58,02. D. 46,86.
Đọc tiếp
Cho hỗn hợp gồm 8,40 gam Fe và 10,56 gam Cu vào dung dịch HNO3 loãng, kết thúc phản ứng thấy thoát ra 0,15 mol khí NO (sản phẩm khử duy nhất của N+5), đồng thời thu được dung dịch chứa m gam muối. Giá trị của m là:
A.65,46.
B. 41,10.
C. 58,02.
D. 46,86.