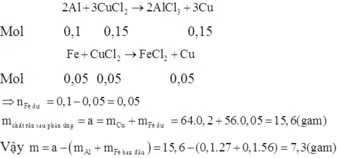Khối lượng của 0,2 mol Al ( biết M Al=27 g/mol ) là bao nhiêu ?

Những câu hỏi liên quan
5,4 gam Al tương ứng với bao nhiêu mol biết rằng nguyên tử khối của Al = 27 đvC ?
A.
0,1 mol
B.
1 mol
C.
0,2 mol
D.
2 mol
Xem thêm câu trả lời
Trong 54g nhôm có bao nhiêu gam electron biết rằng khối lượng mol nguyên tử Al là 27 gam và trong 1 nguyên tử Al có 13 electron?
$n_{Al} = 54 : 27 = 2(mol)$
Số nguyên tử Al là $2.6.10^{23} = 12.10^{23}$ nguyên tử
Số hạt electron là : $13.12.10^{23} = 156.10^{23}$ hạt
Khối lượng electron :$m_e = 9,1.10^{-31}.156.10^{23} = 1,4196.10^{-5}$(gam)$
Đúng 1
Bình luận (0)
Sao đề không cho khối lương 1e nhỉ?
Đúng 0
Bình luận (0)
24Thể tích của 0,25 mol khí CO2 ở (đktc) là bao nhiêu? A.33,6 lít. B.5,6 lít. C.11,2 lít. D.6,72 lít. 25Thành phần phần trăm về khối lượng của Al trong Al2O3 là bao nhiêu? (Cho Al 27; O 16) A.64,94% B.80,94% C.52,94% D.60,94%
Đọc tiếp
24
Thể tích của 0,25 mol khí CO2 ở (đktc) là bao nhiêu?
A.
33,6 lít.
B.
5,6 lít.
C.
11,2 lít.
D.
6,72 lít.
25
Thành phần phần trăm về khối lượng của Al trong Al2O3 là bao nhiêu? (Cho Al = 27; O = 16)
A.
64,94%
B.
80,94%
C.
52,94%
D.
60,94%
Hỗn hợp A có chứa 0,2 mol Al, 0,25 mol Fe và 0,5 mol Zn. Khối lượng hỗn hợp A là
\(m_{Al}=0,2.27=5,4\) ( g )
\(m_{Fe}=0,25.56=14\) ( g )
\(m_{Zn}=0,5.65=32,5\) ( g )
=> \(m_{hh_A}=5,4+14+32,5=51,9\) ( g )
Đúng 2
Bình luận (0)
Cho hỗn hợp X gồm 0,1 mol Fe và 0,1 mol Al tác dụng với dung dịch chứa 0,2 mol CuCl2 đến khi phản ứng hoàn toàn thấy khối lượng chất rắn tăng m gam. Giá trị của m là: A. 7,3 B. 4,5 C. 12,8 D. 7,7
Đọc tiếp
Cho hỗn hợp X gồm 0,1 mol Fe và 0,1 mol Al tác dụng với dung dịch chứa 0,2 mol CuCl2 đến khi phản ứng hoàn toàn thấy khối lượng chất rắn tăng m gam. Giá trị của m là:
A. 7,3
B. 4,5
C. 12,8
D. 7,7
Đốt cháy 5.4g Al trong không khí thu được 10,2g hợp chất nhôm oxit (Al2O3)
A) lập pthh của phản ứng
B) tính khối lượng của oxi đã phản ứng
D) nếu có 0,2 mol Al tham gia phản ứng thì tạo thànhbao nhiêu mol Al2O3
a)
\(4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3\)
b)
Bảo toàn khối lượng:
\(m_{Al} + m_{O_2} = m_{Al_2O_3}\\ \Rightarrow m_{O_2} = 10,2 - 5,4 = 4,8(gam)\)
d)
Theo PTHH : \(n_{Al_2O_3} = 0,5n_{Al} = 0,1(mol)\)
Đúng 1
Bình luận (2)
khi cho miếng Al tan hết vào dung dịch HCL có chứa 0,2 mol thì sinh ra 1,12 lít khí hidro (đktc)
a, Tính khối lượng nhôm đã phản ứng?
b, Axit còn dư k? Nếu còn dư thì khối lượng là bao nhiêu?
a)
\(n_{H_2} = \dfrac{1,12}{22,4} = 0,05(mol)\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\)
Ta thấy :
\(n_{HCl} = 0,2 > 2n_{H_2} = 0,1\) nên HCl dư.
Theo PTHH : \(n_{Al} = \dfrac{2}{3}n_{H_2} = \dfrac{1}{30}(mol)\\ \Rightarrow m_{Al} = \dfrac{1}{30}.27 = 0,9(gam)\)
Ta có :
\(n_{HCl\ pư} = 2n_{H_2} = 0,1(mol)\\ \Rightarrow n_{HCl\ dư} = 0,2 - 0,1 = 0,1(mol)\\ \Rightarrow m_{HCl\ dư} = 0,1.36,5 = 3,65(gam)\)
Đúng 2
Bình luận (1)
hòa tan hết m gam hỗn hợp 3 kl fe, cu,al trong 150 g H2SO4 x phần trăm kết thúc thu được dung dịch Y có kl tăng 14,2g và hỗn hợp sản phẩm là 0,2 mol SO2, 0,15 mol S ,0,05 Mol H2S
a, tinh m,x biết khối lượng axit dùng dư 16,67 phần trăm so với khối lượng ban đầu
b, C phần trăm của axit trong Y
Hoà tan một hỗn hợp gồm 0,2 mol Al và 0,15 mol Al2O3 trong dung dịch gồm KNO3 và a mol H2SO4 vừa đủ thu được dung dịch T và 2,688 lít (đktc) hỗn hợp M có khối lượng 0,76 gam gồm 2 khí (đều là đơn chất). Giá trị của a là: A. 0,785 B. 1,590 C. 1,570 D. 0,795
Đọc tiếp
Hoà tan một hỗn hợp gồm 0,2 mol Al và 0,15 mol Al2O3 trong dung dịch gồm KNO3 và a mol H2SO4 vừa đủ thu được dung dịch T và 2,688 lít (đktc) hỗn hợp M có khối lượng 0,76 gam gồm 2 khí (đều là đơn chất). Giá trị của a là:
A. 0,785
B. 1,590
C. 1,570
D. 0,795