Đố ai cân bằng được:
Cl2+KOH->KCL+1KClO+H2O
K cân bằng được thì hỏi nghen
Hệ cân bằng sau được thực hiện trong bình kín:
C O k + H 2 O k ⇄ C O 2 k + H 2 k ; ∆ H < 0
Cân bằng trên chuyển dịch theo chiều thuận khi
A. cho chất xúc tác vào
B. thêm khí H2 vào hệ
C. tăng áp suất chung của hệ
D. giảm nhiệt độ của hệ
Dựa vào nguyên lý Le Chatelier ta xét các thay đổi cân bằng:
A. Khi thêm chất xúc tác thì cân bằng không bị chuyển dịch mà chỉ làm cho phản ứng nhanh đạt trạng thái cân bằng tức là thay đổi tốc độ phản ứng.
B. Khi thêm khí H2 vào hệ → Cân bằng chuyển dịch theo chiều giảm H2 tức là chiều nghịch.
C. Khi tăng áp suất chung của hệ thì cân bằng không bị chuyển dịch do số mol khí ở trước và sau phản ứng bằng nhau.
D. Khi giảm nhiệt độ của hệ → Cân bằng chuyển dịch theo chiều tăng nhiệt độ của hệ tức là chiều tỏa nhiệt (chiều thuận).
Chọn đáp án D
\(Cl_2 + 2e \to 2Cl^-\\ Cl_2 \to 2Cl^{+5} + 10e\) \(x\ 5\\ x\ 1\)
Điền 5 vào KCl, điền 1 vào KClO3
\(3Cl_2 + 6KOH \xrightarrow{t^o} 5KCl + KClO_3 + 3H_2O\)
biện luận và thay x bằng giá trị cụ thể và cân bằng: CuClx+KOH->Cu(OH)x+KCl
\(CuCl_x+xKOH\rightarrow Cu\left(OH\right)_x+xKCl\)
Cho phản ứng sau: C r I 3 + C l 2 + K O H → K 2 C r O 4 + K I O 4 + K C l + H 2 O
Sau khi cân bằng phản ứng, tổng hệ số (các số nguyên tố cùng nhau) của các chất ban đầu bằng
A. 90
B. 93
C. 92
D. 94
Cho các cân bằng sau
1 2 S O 2 k + O 2 k ⇆ x t , t ∘ 2 S O 2 k
2 N 2 k + 3 H 2 k ⇆ x t , t ∘ 2 N H 3 k
3 C O 2 k + H 2 ⇆ t ∘ C O k + H 2 O k
4 2 H I k ⇆ t ∘ H 2 k + I 2 k
Khi thay đổi áp suất, nhóm gồm các cân bằng hóa học đều không bị chuyển dịch là:
A. (1) và (3)
B. (3) và (4)
C. (2) và (4)
D. (1) và (2)
Chọn B
Các cân bằng mà số mol 2 về bằng nhau thì không chịu sự ảnh hưởng của áp suất
Cho các cân bằng sau:
( 1 ) 2 S O 2 k + O 2 k ⇄ x t , t 2 S O 2 k ( 2 ) N 2 k + 3 H 2 k ⇄ x t , t 2 N H 3 k ( 3 ) C O 2 k + H 2 k ⇄ x t , t C O k + H 2 O k ( 4 ) 2 H I k ⇄ x t , t H 2 k + I 2 k ( 5 ) C H 3 C O O H l + C 2 H 5 O H l ⇄ x t , t C H 3 C O O C 2 H 5 l + H 2 O l
Khi thay đổi áp suất, nhóm gồm các cân bằng hoá học đều không bị chuyển dịch là
A. (1) và (2).
B. (3) và (4).
C. (3), (4) và (5).
D. (2), (4) và (5).
Khi thay đổi áp suất trong bình (giữ nguyên các yếu tố nhiệt độ, nồng độ các chất) thì ở các phản ứng không có chất khí hoặc số mol chất khí ở trước và sau phản ứng bằng nhau thì cân bằng sẽ không bị chuyển dịch. Các phản ứng (3), (4), (5) thỏa mãn.
Chọn đáp án C
Trong bình kín có hệ cân bằng hóa học sau:
C O 2 k + H 2 k ⇄ C O k + H 2 O k ; ∆ H > 0
Xét các tác động sau đến hệ cân bằng:
(a) Tăng nhiệt độ;
(b) Thêm một lượng hơi nước;
(c) Giảm áp suất chung của hệ;
(d) Dùng chất xúc tác;
(e) Thêm một lượng CO2;
Trong những tác động trên, các tác động làm cân bằng chuyển dịch theo chiều thuận là
A. (a), (c) và (e)
B. (a) và (e).
C. (d) và (e).
D. (b), (c) và (d).
Dựa vào nguyên lý Le Chatelier ta xét các thay đổi cân bằng:
(a) Khi tăng nhiệt độ → thì cân bằng sẽ chuyển dịch theo chiều giảm nhiệt độ tức là chiều thu nhiệt (chiều thuận).
(b) Khi thêm một lượng hơi nước → thì cân bằng sẽ chuyển dịch theo chiều giảm hơi nước tức là chiều nghịch.
(c) Khi tăng áp suất chung của hệ thì cân bằng không bị chuyển dịch do số mol khí ở trước và sau phản ứng bằng nhau.
(d) Khi dùng chất xúc tác thì cân bằng không bị chuyển dịch mà chỉ làm cho phản ứng nhanh đạt trạng thái cân bằng tức là chỉ thay đổi tốc độ phản ứng.
(e) Khi thêm một lượng CO2 → Cân bằng sẽ chuyển dịch theo chiều giảm CO2 tức là chiều thuận.
Chọn đáp án B
Cân bằng các phương trình phản ứng oxi hóa – khử sau đây bằng phương pháp thăng bằng electron và cho biết chất khử, chất oxi hóa ở mỗi phản ứng:
a) Al + Fe3O4 → Al2O3 + Fe
b) FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
c) FeS2 + O2 → Fe2O3 + SO3
d) KClO3 → KCl + O2
e) Cl2 +KOH → KCl + KClO3 + H2O
Cân bằng các phương trình phản ứng oxi hóa – khử:
![]()
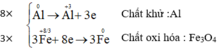
![]()
![]()

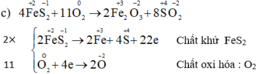

cân bằng phản ứng ôxi hóa khử
1. As2S3 + HNO3 + H2O ![]() H3AsO4 + H2SO4 + NO.
H3AsO4 + H2SO4 + NO.
2. CrI3 + Cl2 + KOH ![]() K2CrO4 + KIO4 + KCl + H2O
K2CrO4 + KIO4 + KCl + H2O
3. CuFeS2 + O2 ![]() Cu2S + SO2 + Fe2O3
Cu2S + SO2 + Fe2O3
4. FeS + H2SO4 ![]() Fe2(SO4)3 + SO2 + H2O
Fe2(SO4)3 + SO2 + H2O
5. FeS2 + HNO3 ![]() Fe(NO3)3 + H2SO4 + NO2 + H2O.
Fe(NO3)3 + H2SO4 + NO2 + H2O.
6. Fe3C + HNO3 ![]() Fe(NO3)3 + CO2 + NO + H2O
Fe(NO3)3 + CO2 + NO + H2O
1.
| \(As_2^{+3}S_3^{-2}\rightarrow2As^{+5}+3S^{+6}+28e\) | `xx3` |
| \(N^{+5}+3e\rightarrow N^{+2}\) | `xx28` |
\(3As_2S_3+28HNO_3+4H_2O\rightarrow6H_3AsO_4+9H_2SO_4+28NO\)
2.
| \(Cr^{+3}I_3^{-1}\rightarrow Cr^{+6}+3I^{+7}+27e\) | `xx2` |
| \(Cl_2+2e\rightarrow2Cl^{-1}\) | `xx27` |
\(2CrI_3+27Cl_2+64KOH\rightarrow2K_2CrO_4+6KIO_4+54KCl+32H_2O\)
3. Tạo CuO chứ bạn?
| \(2Cu^{+2}Fe^{+2}S_2^{-2}\rightarrow2Cu^{+2}+2Fe^{+3}+4S^{+4}+26e\) | `xx2` |
| \(O_2+2e\rightarrow2O^{-2}\) | `xx13` |
\(4CuFeS_2+13O_2\xrightarrow[]{t^o}4CuO+2Fe_2O_3+8SO_2\)
4.
| \(2Fe^{+2}S^{-2}\rightarrow2Fe^{+3}+2S^{+6}+18e\) | `xx1` |
| \(S^{+6}+2e\rightarrow S^{+4}\) | `xx9` |
\(2FeS+10H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+9SO_2+10H_2O\)
5.
| \(Fe^{+2}S_2^{-1}\rightarrow Fe^{+3}+2S^{+6}+15e\) | `xx1` |
| \(N^{+5}+e\rightarrow N^{+4}\) | `xx30` |
\(FeS_2+18HNO_3\rightarrow Fe\left(NO_3\right)_3+2H_2SO_4+15NO_2+7H_2O\)
6.
| \(Fe^{+2}_3C^{-6}\rightarrow3Fe^{+3}+C^{+4}+13e\) | `xx3` |
| \(N^{+5}+3e\rightarrow N^{+2}\) | `xx13` |
\(3Fe_3C+40HNO_3\rightarrow9Fe\left(NO_3\right)_3+3CO_2+13NO+20H_2O\)
Cân bằng phản ứng oxi hóa khử
1. 3As2S3 + 28HNO3 + 4H2O →6H3AsO4 + 9H2SO4 + 28NO
2. 2CrI3 + 64KOH + 27Cl2 → 2K2CrO4 + 6KIO4 + 54KCl + 32H2O
3. 4CuFeS2 + 9O2 → 2Cu2S + 2Fe2O3 + 6SO2
4. 2FeS + 10H2SO4 → Fe2(SO4)3 + 9SO2 + 10H2O
5. FeS2 + 18HNO3 → 15NO2 + Fe(NO3)3 + 7H2O + 2H2SO4
6. 3Fe3C + 40HNO3 → 3CO2 + 9Fe(NO3)3+ 13NO + 20H2O