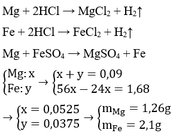cho HCl loãng dư tác dụng với hợp kim nhôm và sắt thu được 12,32(l) khí ở đktc .Nếu hợp kim này tác dụng với dd FeSO4 dư thì khối lượng hợp kim tăng lên 19(g) .Tính %về khối lượng của kim loại có trong hợp kim

Những câu hỏi liên quan
Cho H2SO4 loãng dư tác dụng với hợp kim Mg, Fe thu được 2,016 lít khí ở đktc. Nếu hợp kim này tác dụng với dung dịch FeSO4 dư thì khối lượng hợp kim tăng lên 1,68 gam. Tính khối lượng mỗi kim loại trong hợp kim
Cho 15g hợp kim Nhôm-Magie tác dụng với dd HCl dư. Sau phản ứng thu được 15,68 lít khí(đktc). Tính thành phần % theo khối lượng của mỗi kim loại trong hợp kim ban đầu.
Cho 15g hợp kim Nhôm-Magie tác dụng với dd HCl dư. Sau phản ứng thu được 15,68 lít khí(đktc). Tính thành phần % theo khối lượng của mỗi kim loại trong hợp kim ban đầu.
Cho 15g hợp kim Nhôm-Magie tác dụng với dd HCl dư. Sau phản ứng thu được 15,68 lít khí(đktc). Tính thành phần % theo khối lượng của mỗi kim loại trong hợp kim ban đầu.
ai giúp mình với
Cho 8,3 g hỗn hợp gồm nhôm và sắt tác dụng với dung dịch
H
2
SO
4
loãng dư. Sau PƯ thu được 5,6 lít khí đo ở đktc. Tính thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp đầu. A. 32% và 68% B. 40% và 60% C. 32,5% và 67,5% D. 30% và 70%
Đọc tiếp
Cho 8,3 g hỗn hợp gồm nhôm và sắt tác dụng với dung dịch H 2 SO 4 loãng dư. Sau PƯ thu được 5,6 lít khí đo ở đktc. Tính thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp đầu.
A. 32% và 68%
B. 40% và 60%
C. 32,5% và 67,5%
D. 30% và 70%
Đáp án C
Gọi a, b là số mol của Al và Fe trong 8,3 g hỗn hợp ban đầu

Đúng 0
Bình luận (0)
cho 0.84g hỗn hợp gồm nhôm và sắt tác dụng với dd h2so4 loãng dư sau phản ứng thu được 0,56 lit khí ở (đktc)
a) viết pthh
b) tính thành phần trăm theo khối lượng cảu mỗi kim loại trong hỗ hợp ban đầu
a)
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
$Fe + H_2SO_4 \to FeSO_4 + H_2$
b)
Gọi $n_{Al} = a(mol) ; n_{Fe} = b(mol) \Rightarrow 27a + 56b = 0,83(1)$
Theo PTHH : $n_{H_2} = 1,5a + b = \dfrac{0,56}{22,4} = 0,025(2)$
Từ (1)(2) suy ra : a = 0,01; b = 0,01
$\%m_{Al} = \dfrac{0,01.27}{0,84}.100\% = 32,1\%$
$\%m_{Fe} = 100\% - 32,1\% = 67,9\%$
Đúng 0
Bình luận (0)
Cho 15g hợp kim Nhôm-Magie tác dụng với dd HCl dư. Sau phản ứng thu được 15,68 lít khí(đktc). Tính thành phần % theo khối lượng của mỗi kim loại trong hợp kim ban đầu.
giải chi tiết giúp mình với ạ
cho 4 gam hỗn hợp gồm 2 kim loại Zn ,Al tác dụng với dd HCL loãng dư thì thu được 3808ml (đktc).tính khối lượng từng kim loại trong hỗn hợp ban đầu
Zn+2HCl->ZnCl2+H2
x-------------------------x mol
2Al+6HCl->2AlCl3+3H2
y----------------------------3\2 y mol
=> ta có :
65x+27y=4
x+3\2y=0,17
=>x=0,02mol
y=0,1 mol
=>%m Zn=0,02.65\4 100=32,5%
=>%m Al=67,5%
Đúng 1
Bình luận (0)
cho 8,3 g hỗn hợp nhôm , sắt tác dụng với HCl dư thu được 5,6 lít H2 (đktc) . tìm thành phần % về khối lượng của 2 kim loại
$n_{Al} = a(mol) ; n_{Fe} = b(mol) \Rightarrow 27a + 56b = 8,3(1)$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$Fe + 2HCl \to FeCl_2 + H_2$
$n_{H_2} = 1,5a + b = \dfrac{5,6}{22,4} = 0,25(2)$
Từ (1)(2) suy ra a = b = 0,1
$\%m_{Al} = \dfrac{0,1.27}{8,3}.100\% = 32,53\%$
$\%m_{Fe} = 100\% - 32,53\% = 67,47\%$
Đúng 4
Bình luận (0)