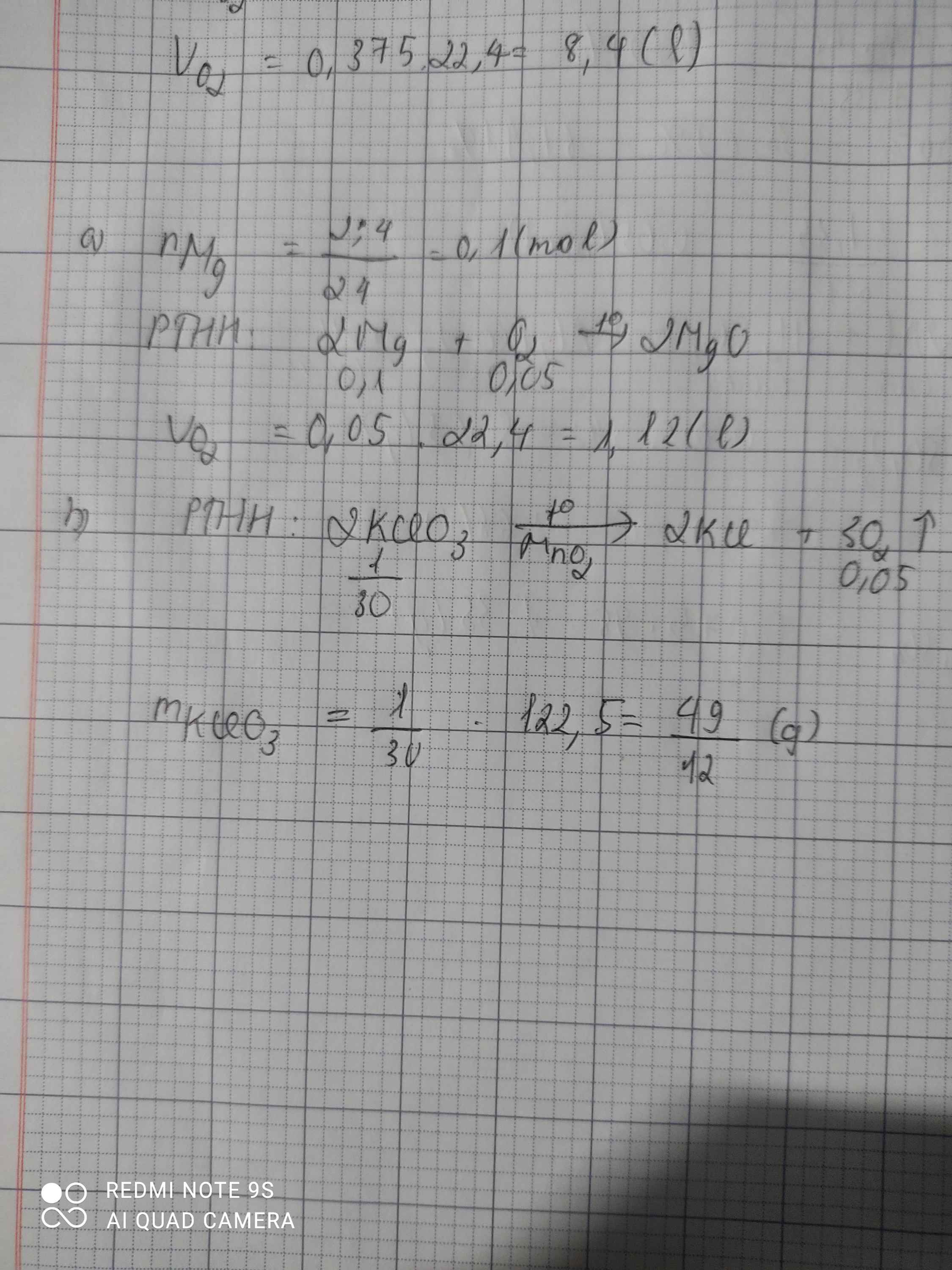tính thể tích khí Oxi và Hiđro ở đktc để điều chế 900g nước

Những câu hỏi liên quan
Tính thể tích khí oxi và hidro ở đktc để điều chế 900g nước
nh2o=900:18=50 mol
pt 2H2 + O2--> 2H2O
50 ........ 25 ...... 50
Vh2=nh2.22,4=1120(l)
Vo2=no2.22,4=25.22,4=560(l)
Đúng 0
Bình luận (0)
Cho 12 gam magie tác dụng với oxi A, viết pthh B, tính thể tích khí oxi và không khí ở đktc .Biết thể tích oxi chiếm 1/5 thể tích không khí c, tính khối lượng KCLO cần dùng để điều chế lượng oxi cho phản ứng trên
\(a) 2Mg + O_2 \xrightarrow{t^o} 2MgO\\ n_{Mg} = \dfrac{12}{24} = 0,5(mol)\\ n_{O_2} = \dfrac{1}{2}n_{Mg} = 0,25(mol)\\ V_{O_2} = 0,25.22,4 = 5,6(lít)\\ V_{không\ khí} = 5V_{O_2} = 5,6.5 = 28(lít)\)
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 16,8 lít khí hidro.
a)Tính thể tích khí oxi và thể tích không khí cần dùng cho phản ứng trên (biết các thể tích đo ở đktc và oxi chiếm 20% thể tích không khí)
b)tính khối lượng KMnO4(hoặc KClO3)cần dùng để điều chế đc lượng oxi trên
Theo gt ta có: $n_{H_2}=0,75(mol)$
a, $2H_2+O_2\rightarrow 2H_2O$
Ta có: $n_{O_2}=0,5.n_{H_2}=0,375(mol)\Rightarrow V_{O_2}=8,4(l)\Rightarrow V_{kk}=42(l)$
b, $2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2$
Ta có: $n_{KMnO_4}=2.n_{O_2}=0,75(mol)\Rightarrow m_{KMnO_4}=118,5(g)$
Đúng 1
Bình luận (0)
a)
\(2H_2 + O_2 \xrightarrow{t^o} 2H_2O\\ V_{O_2} = \dfrac{V_{H_2}}{2} = \dfrac{16,8}{2} = 8,4(lít)\\ V_{không\ khí} = \dfrac{8,4}{20\%} = 42(lít)\)
b)
\(n_{O_2} = \dfrac{8,4}{22,4} = 0,375(mol)\\ 2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2\\ n_{KMnO_4} = 2n_{O_2} = 0,75(mol)\\ \Rightarrow m_{KMnO_4} = 0,75.158 = 118,5(gam)\\ 2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\\ n_{KClO_3} = \dfrac{2}{3}n_{O_2} = 0,25(mol)\\ \Rightarrow m_{KClO_3} = 0,25.122,5 = 30,625(gam)\)
Đúng 1
Bình luận (0)
\(n_{H_2}=\dfrac{16.8}{22.4}=0.75\left(mol\right)\)
\(2H_2+O_2\underrightarrow{t^0}2H_2O\)
\(0.75...0.375\)
\(V_{O_2}=0.375\cdot22.4=8.4\left(l\right)\)
\(V_{kk}=5V_{O_2}=8.4\cdot5=42\left(l\right)\)
\(2KMnO_4\underrightarrow{t^0}K_2MnO_4+MnO_2+O_2\)
\(0.75..............................................0.375\)
\(m_{KMnO_4}=0.75\cdot158=118.5\left(g\right)\)
\(2KClO_3\underrightarrow{t^0}2KCl+3O_2\)
\(0.25.......................0.375\)
\(m_{KClO_3}=0.25\cdot122.5=30.625\left(g\right)\)
Đúng 1
Bình luận (0)
Xem thêm câu trả lời
Để điều chế 11.2 gam sắt người ta dùng khí hiđro khử oxit sắt từ .Tính :
a. Khối lượng sắt từ oxit cần dùng
b. Thể tích khí hiđro cần dùng ở đktc
a)
\(n_{Fe} = \dfrac{11,2}{56} = 0,2(mol)\\ Fe_3O_4 + 4H_2 \xrightarrow{t^o} 3Fe + 4H_2O\\ n_{Fe_3O_4} = \dfrac{1}{3}n_{Fe} = \dfrac{1}{15}(mol)\\ \Rightarrow m_{Fe_3O_4} = \dfrac{1}{15}.232 = 15,467(gam)\)
b)
\(n_{H_2} = \dfrac{4}{3}n_{Fe} = \dfrac{4}{15}(mol)\\ \Rightarrow V_{H_2} =\dfrac{4}{15}.22,4 = 5,973(lít)\)
Đúng 1
Bình luận (0)
\(n_{Fe}=\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PTHH: \(Fe_3O_4+4H_2\underrightarrow{t^o}3Fe+4H_2O\)
...............1...............4..............3.....................
...............1/15.........4/15.........0,2..................
a. \(m_{Fe_3O_4}=n_{Fe_3O_4}\cdot M_{Fe_3O_4}=\dfrac{1}{15}\cdot232=\dfrac{232}{15}\left(g\right)\)
b. \(V_{H_2\left(ĐKTC\right)}=n_{H_2}\cdot22,4=\dfrac{4}{15}\cdot22,4=\dfrac{448}{75}\left(l\right)\)
Đúng 1
Bình luận (0)
a) Tính khối lượng oxi cần dùng để đốt cháy 11,2 lít khí hiđro ở đktc b) tính khối lượng kali pennang rat cần dùng để điều chế lượng khí oxi nói trên
\(n_{H_2}=\dfrac{11.2}{22.4}=0.5\left(mol\right)\)
\(a.\)
\(2H_2+O_2\underrightarrow{^{^{t^0}}}2H_2O\)
\(0.5.......0.25\)
\(m_{O_2}=0.25\cdot32=8\left(g\right)\)
\(b.\)
\(2KMnO_4\underrightarrow{^{^{t^0}}}K_2MnO_4+MnO_2+O_2\)
\(0.5............................................0.25\)
\(m_{KMnO_4}=0.5\cdot158=79\left(g\right)\)
Đúng 2
Bình luận (2)
Để điều chế Fe3O4 người ta dùng Oxi để oxi hóa Sắt ở nhiệt độ cao.
a) Tính khối lượng Sắt và thể tích khí Oxi cần dùng (đktc) để điều chế 17,4 g oxit sắt từ.
b) Tính số g KClO3 cần dùng để được lượng Oxi dùng cho phản ứng trên.
Giúp mình với ạ ^^
nFe3O4 = 17.4/232 = 0.075 (mol)
3Fe + 2O2 -to-> Fe3O4
0.225__0.15_____0.075
mFe = 0.225*56=12.6 (g)
VO2 = 0.15*22.4 = 3.36 (l)
2KClO3 -to-> 2KCl + 3O2
0.1________________0.15
mKClO3 = 0.1*122.5 = 12.25 (g)
Đúng 2
Bình luận (1)
Đốt cháy hoàn toàn 2,4g magie (Mg) trong khí oxi thu được magie oxit (MgO)
a) Tính thể tích khí oxi cần dùng (thể tích khí đo ở đktc)
b) Tính số gam KClO3 cần dùng để điều chế lượng oxi trên
\(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\\ a,2Mg+O_2\rightarrow\left(t^o\right)2MgO\\ n_{O_2}=\dfrac{0,1}{2}=0,05\left(mol\right)\\ V_{O_2\left(đktc\right)}=0,05.22,4=1,12\left(l\right)\\ b,2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\\ n_{KClO_3}=\dfrac{0,05.2}{3}=\dfrac{1}{30}\left(mol\right)\\ \Rightarrow m_{KClO_3}=\dfrac{122,5}{30}=\dfrac{49}{12}\left(g\right)\)
Đúng 1
Bình luận (0)
Bài 32: Điện phân hoàn toàn 3,6 gam nước ở trạng thái lỏng. Tính thể tích khí hiđro và khí oxi thu được ở đktc?
\(n_{H_2O}=\dfrac{3,6}{18}=0,2\left(mol\right)\\
pthh:2H_2O\underrightarrow{\text{đ}p}2H_2+O_2\)
0,2 0,2 0,1
=> \(\left\{{}\begin{matrix}V_{H_2}=0,2.22,4=4,48\left(L\right)\\V_{O_2}=0,1.22,4=2,24\left(L\right)\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Tính thể tích khí hiđro và oxi(đktc) cần tác dụng với nhau để tạo ra được 1,8g nước.
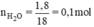
Phương trình phản ứng:
2H2 + O2 → 2H2O.
Đúng 0
Bình luận (0)