một quặng photphat có 35% Ca3(PO4)2 . Hãy tính hàm lượng phần trăm P2O5 có trong quặng trên .

Những câu hỏi liên quan
Một loại quặng photphat có chứa 35% Ca3(PO4)2. Hãy tính hàm lượng phần trăm P2O5 có trong quặng trên.
Trong 1000g quặng có: 1000. 35% = 350g Ca3(PO4)2
Bảo toàn nguyên tố P ⇒ trong 1 mol Ca3(PO4)2 có 1mol P2O5 nghĩa là trong 310g Ca3(PO4)2 tương ứng có 142g P2O5.
⇒350g Ca3(PO4)2 có lượng P2O5 là:
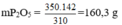
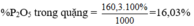
Đúng 0
Bình luận (0)
Khối lượng P2O5 có trong 5 tấn quặng photphat chứa 35% Ca3(PO4)2 là
A. 0,5 tấn B. 0,8 tấn C. 0,7 tấn D. 0,85 tấn
\(m_{Ca_3\left(PO_4\right)_2}=5.35\%=1,75\left(tấn\right)\)
Trong 1 mol Ca3(PO4)2 có 1 mol P2O5
=> Trong 310 tấn Ca3(PO4)2 tương ứng có 142 tấn P2O5
=> Trong 1,75 tấn Ca3(PO4)2 tương ứng có x tấn P2O5
=> x=\(\dfrac{1,75.142}{310}=0,8\left(tấn\right)\)
=> Chọn B
Đúng 2
Bình luận (0)
một quặng photphat có 35% Ca3(PO4)2 . Hãy tính hàm lượng phần trăm P2O5 có trong quặng trên .
Có thể tính như sau: Trong 310 gam Ca3(PO4)2(3CaO.P2O5) có chứa x gam P2O5.
Từ đó ta tính được khối lượng P2O5: x = 142 x (35 : 310) = 16 (g)
Hàm lượng P2O5 là 6%.
Đúng 0
Bình luận (0)
1 loại quặng photphat chứa 60% là tạp chất, còn lại là ca3(po4)2. Nếu dùng 20 tấn quặng này thì lượng p2o5 điều chế được là bao nhiêu
\(m_{Ca_3\left(PO_4\right)_2}=20\cdot40\%=8\left(tấn\right)=8000\left(kg\right)\)
\(n_{Ca_3\left(PO_4\right)_2}=\dfrac{8000}{310}=\dfrac{800}{31}\left(kmol\right)\)
Bảo toàn nguyên tố P :
\(n_{P_2O_5}=n_{Ca_3\left(PO_4\right)_2}=\dfrac{800}{31}\left(kmol\right)\)
\(m_{P_2O_5}=\dfrac{800}{31}\cdot142=3664.5\left(kg\right)\)
Đúng 2
Bình luận (0)
$m_{Ca_3(PO_4)_2} = 20.(100\%-60\%) = 8(tấn) = 8000(kg)$
Bảo toàn P
$n_{P_2O_5} = n_{Ca_3(PO_4)_2} = \dfrac{8000}{310}(kmol)$
$m_{P_2O_5} = \dfrac{8000}{310}.142 = 3664,5(kg)$
Đúng 0
Bình luận (0)
Một loại quặng photphat có chứa 35% Ca3(PO4)2. Hãy tính hàm lượng phần trăm P2O5 có trong quặng trên.
Để điều chế phân đạm NH4NO3 cần phải có NH3 và HNO3.
Từ không khí, than, nước, có thể lập sơ đồ điều chế phân đạm NH4NO3 như sau:
 → NO → NO2 → HNO3 → NH4NO3
→ NO → NO2 → HNO3 → NH4NO3
C + O2 → CO2: cung cấp nhiệt cho các phản ứng.
Đúng 0
Bình luận (0)
Có thể tính như sau: Trong 310 gam Ca3(PO4)2(3CaO.P2O5) có chứa x gam P2O5.
Từ đó ta tính được khối lượng P2O5: x = 142 x (35 : 310) = 16 (g)
Hàm lượng P2O5 là 6%.
Đúng 0
Bình luận (0)
Trong 310 gam Ca3(PO4)2(3CaO.P2O5) có chứa x gam P2O5.
Từ đó ta tính được khối lượng P2O5: x = 142 x (35 : 310) = 16 (g)
Hàm lượng P2O5 là 6%.
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Một loại quặng photphat dùng để làm phân bón có chứa 35% Ca3(PO4) về khối lượng, còn lại là các chất không chứa photphat. Độ dinh dưỡng của loại phân lân này là: A. 7%. B. 16,03%. C. 25% D. 35%
Đọc tiếp
Một loại quặng photphat dùng để làm phân bón có chứa 35% Ca3(PO4) về khối lượng, còn lại là các chất không chứa photphat. Độ dinh dưỡng của loại phân lân này là:
A. 7%.
B. 16,03%.
C. 25%
D. 35%
Đáp án B
Độ dinh dưỡng của phân lân được đánh giá bằng hàm lượng P2O5 có trong loại phân đó
Lấy 100 gam quặng => mCa3(PO4)2 = 35 (g) => nCa3(PO4)2 = 0,1129 (mol)
BTNT P: => nP2O5 = nCa3(PO4)2 = 0,1129 (mol)
=> Độ dinh dưỡng =% P2O5 = [( 0,1129. 142) :100].100% = 16,03%
Đúng 0
Bình luận (0)
Cho sơ đồ phản ứng sau : Ca3(PO4)2 → P → P2O5 → H3PO4. Để điều chế được 5 lít H3PO4 2M cần dùng hết bao nhiêu kg quặng photphorit ? biết hiệu suất của cả quá trình là 80%, hàm lượng Ca3(PO4)2 trong quặng chiếm 95%. A. 1,55 kg B. 1,95 kg C. 2,14 kg D. 2,04 kg
Đọc tiếp
Cho sơ đồ phản ứng sau : Ca3(PO4)2 → P → P2O5 → H3PO4. Để điều chế được 5 lít H3PO4 2M cần dùng hết bao nhiêu kg quặng photphorit ? biết hiệu suất của cả quá trình là 80%, hàm lượng Ca3(PO4)2 trong quặng chiếm 95%.
A. 1,55 kg
B. 1,95 kg
C. 2,14 kg
D. 2,04 kg
Đáp án : D
Giả sử cần mg quặng => mCa3(PO4)2 = 0,95m (g)
=> Thực tế chỉ có 0,8.0,95m = 0,76m (g) Ca3(PO4)2 phản ứng
Ca3(PO4)2 -> 2H3PO4
310g 2.98g
0,76m(g) 980g
=> m = 2040g = 2,04 kg
Đúng 0
Bình luận (0)
Một loại quặng photphat dùng để làm phân bón có chứa 35% Ca3(PO4)2 về khối lượng, còn lại là các chất không chứa photpho. Độ dinh dưỡng của loại phân lân này là A. 7%. B. 16,03%. C. 25%. D. 35%.
Đọc tiếp
Một loại quặng photphat dùng để làm phân bón có chứa 35% Ca3(PO4)2 về khối lượng, còn lại là các chất không chứa photpho. Độ dinh dưỡng của loại phân lân này là
A. 7%.
B. 16,03%.
C. 25%.
D. 35%.
Đáp án B
Giả sử khối lượng phân là 100g
⇒ mCa3(PO4)3 = 35 gam.
Bảo toàn nguyên tố ta có:
Ca3(PO4)2 → P2O5.
⇒ mP2O5 = 35 × 142/310 = 16,03 gam.
⇒ Độ dinh dưỡng của phân bón đã cho = ![]() = 16,03%.
= 16,03%.
Đúng 0
Bình luận (0)
Một loại quặng photphat dùng để làm phân bón có chứa 35% Ca3(PO4)2 về khối lượng, còn lại là các chất không chứa photpho. Độ dinh dưỡng của loại phân lân này là A. 7%. B. 16,03%. C. 25%. D. 35%.
Đọc tiếp
Một loại quặng photphat dùng để làm phân bón có chứa 35% Ca3(PO4)2 về khối lượng, còn lại là các chất không chứa photpho. Độ dinh dưỡng của loại phân lân này là
A. 7%.
B. 16,03%.
C. 25%.
D. 35%.
Đáp án B
Giả sử khối lượng phân là 100g ⇒ mCa3(PO4)3 = 35 gam.
Bảo toàn nguyên tố ta có: Ca3(PO4)2 → P2O5.
⇒ mP2O5 = 35 × 142/310 = 16,03 gam.
⇒ Độ dinh dưỡng của phân bón đã cho = 16,03×100/100 = 16,03%.
Đúng 0
Bình luận (0)















