nguyên tố Cu có 2 đồng vị 63Cu và 65Cu với tỷ lệ số nguyên tử 2 đồng vị là 37:13 . tính nguyên tử khối trung bình của Cu
trong tự nhiên đồng có 2 đồng vị 63cu và 65cu .Nguyên tử khối trung bình của Cu là 63,54. a,Tính phần trăm số nguyên tử mỗi loại đồng vị b.Tính thành phần phần trăm theo khối lượng của 65Cu trong CuSO
a)
Gọi thành phần phần trăm của hai đồng vị 63Cu ,65Cu lần lượt là a,b
Ta có :
a + b = 100%
63a + 65b = 63,54
Suy ra a = 0,73 = 73% ; b = 0,27 = 27%
b) Thành phần phần trăm khối lượng của 65Cu trong CuSO4 là :
\(\dfrac{65.27\%}{63,54 + 32 + 16.4 }.100\% = 11\%\)
1. Nguyên tố Cu có hai đồng vị là 65Cu và 63Cu. Nguyên tử khối trung bình của Cu là 63,5. Vậy cứ có 300 nguyên tử 65Cu th có tương ứng số nguyên tử 63Cu là
A. 750. B. 600. C. 900. D. 1200
2. Hidro được điều chế bằng cách điện phân nước,hidro đó gồm 2 loại đồng vị 1:1H và 2:1D . Biết nguyên tử khối của hidro là 1,008,nguyên tử khối của oxi là 16 rong 27,024 gam nước nói trên có số nguyên tử đồng vị 2:D là
A. 14,214.1021 B. 33,502.1022 C. 13,352.1021 D. 14,455.1021
Mong mọi người giúp đỡ ạ, làm 1 câu cx được nếu được thì làm 2 câu nhe chứ e bí quá
1. Nguyên tố Cu có hai đồng vị là 65Cu và 63Cu. Nguyên tử khối trung bình của Cu là 63,5. Vậy cứ có 300 nguyên tử 65Cu th có tương ứng số nguyên tử 63Cu là
A. 750. B. 600. C. 900. D. 1200
Gọi x là % của đồng vị 63Cu
Ta có : \(\dfrac{63.x+65.\left(100-x\right)}{100}=63,5\)
=> x=75
% 65Cu = 100 - 75 =25 %
=> Cứ 25 nguyên tử 65Cu thì có tương ứng số nguyên tử 63Cu là 75
300------------------------------------------------------------------------------>a
=> a=\(\dfrac{300.75}{25}=900\)
=> Chọn C
2. Hidro được điều chế bằng cách điện phân nước,hidro đó gồm 2 loại đồng vị 1:1H và 2:1D . Biết nguyên tử khối của hidro là 1,008,nguyên tử khối của oxi là 16 rong 27,024 gam nước nói trên có số nguyên tử đồng vị 2:D là
A. 14,214.1021 B. 33,502.1022 C. 13,352.1021 D. 14,455.1021
Gọi x là tỷ lệ phần trăm \(_{1}^{2}\textrm{D}\)
Ta có : \(\frac{2.x+(100-x).}{100}= 1,008\)
=> x=0,8
Trong 1 mol nước có khối lượng 18,016 g có 2.6,023.1023 nguyên tử hidro hay 2.6,023.1023.0,8 % đồng vị D
Vậy trong 27,024 g nước ta có số nguyên tử đồng vị 2D :
\(\frac{27,024.2.6,023.10^{23}.8.10^{-3}}{18,016}=1,4455.10^{22}\)
=> Chọn D
Trong tự nhiên Cu có 2 đồng vị bền là 63Cu và 65Cu. Nguyên tử khối trung bình của Cu là 63,54 đvC. Thành phần phần trăm tổng số nguyên tử của 63Cu là
A. 73%.
B. 27%.
C. 54%.
D. 50%.
Trong tự nhiên đồng có 2 đồng vị là 63Cu và 65Cu. Nguyên tử khối trung bình của Cu là 63,54. Tính thành phần % khối lượng của 63Cu trong CuSO4?
A. 28,83%.
B. 10,97%
C. 11,00%.
D. 28,74%.
Đáp án A
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y.
Ta có hpt:
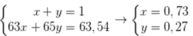
Phần trăm khối lượng của 63Cu trong CuSO4 là
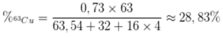
Đồng trong tự nhiên có 2 đồng vị 6529Cu, 6329Cu với tỷ số 63Cu/ 65Cu = 105/ 245.Tính nguyên tử khối của Cu
Phần trăm đồng vị $^{63}Cu$ là : $\dfrac{105}{105 + 245}.100\% = 30\%$
Phần trăm đồng vị $^{65}Cu$ là : $100\% -30\% = 70\%$
Nguyên tử khối Cu : $M = 63.30\% + 65.70\% = 64,4(đvC)$
Trong tự nhiên đồng có 2 đồng vị là 63Cu và 65Cu. biết nguyên tử khối trung bình của Cu là 63,54. Phần trăm khối lượng của 63Cu trong Cu2O là?
A. 73%.
B. 64,29%.
C. 35,71%.
D. 27%.
Đáp án B
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y.
Ta có hpt:
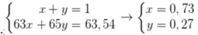
Phần trăm khối lượng của 63Cu trong Cu2O là
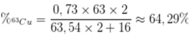
Trong tự nhiên Cu có hai loại đồng vị là 63Cu và 65Cu. Khối lượng nguyên tử trung bình của Cu là 63,54. Hỏi đồng vị 63Cu chiếm bao nhiêu % về khối lượng trong tinh thể CuSO4.5H2O?
A. 18,59 %
B. 27%
C. 73%
D. 18,43%
Gọi x là số phần trăm của đồng vị 63Cu
Suy ra phần trăm đồng vị 65Cu là 100 – x
M = [63.x + 65(100 – x)]/100 = 63,546
<=> x = 72,7%
Từ đây dễ dàng tìm được % của 63Cu trong tinh thể CuSO4.5H2O là 18,43%
=> Đáp án D
7. Nguyên tố Cu có hai đồng vị: 63Cu, 65Cu. NTKTB của Cu là: 63,54.
a. Nếu có 54 nguyên tử 65Cu thì có bao nhiêu nguyên tử 63Cu?
Bài 1: Trong tự nhiên , đồng có 2 đồng vị 65Cu và ACu, trong đó đồng vị 65Cu chiếm 27% về số nguyên tử. Nguyên tử khối trung bình của đồng là 63,54.
a.Tính A.
b.Tính phần trăm khối lượng của 63Cu trong kim loại đồng tự nhiên.
Bài 2: Nguyên tử nguyên tố A có phân mức năng lượng cao nhất là 3s1. Nguyên tử nguyên tố B có cấu hình electron phân lớp ngoài cùng là 3p4. Nguyên tử nguyên tố tố C có tổng số electron ở phân lớp p là 11. Viết cấu hình electron đầy đủ của A, B, C và xác định vị trí của chúng trong bảng tuần hoàn.
Bài 3: Cation X+ và anion Y2- có cấu hình electron ở phân lớp ngoài cùng là 3p6. Hãy xác định vị trí của X ,Y trong bảng tuần hoàn. Hãy cho biết tính chất cơ bản của X,Y: Tính kim loại hay phi kim? Công thức oxit cao nhất? Tính chất (axit hay bazơ) của oxit? Hợp chất khí hidro (nếu có)? Công thức hidroxit tạo nên từ nguyên tố X, Y. Tính chất (axit hay bazơ) của hidroxit? Bài 4: Oxit trong đó nguyên tố R có hóa trị cao nhất là R2O5. R chiếm 91,176% khối lượng trong hợp chất khí với hiđro. Xác định tên nguyên tố R?
Bài 5: X tạo hợp chất khí với hidro là H2X. Trong oxit cao nhất, X chiếm 40% về khối lượng. Xác định tên X.
Giải giúp mình với ạ.
Mình đang cần gấp ạ.