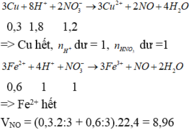Cho 9,2g Na vào 200ml dd chứa đồng thời H2SO4 2M và HCl 0,2M. Sau khi các pư xảy ra hoàn toàn thu được ddA và khí H2. Tính V(H2) và xđ các ion và số mol t/ư của chúng trong dd A

Những câu hỏi liên quan
Hỗn hợp A gồm Na và Na2O, hòa tan hoàn toàn 2,08 gam A vào 1 lượng nước dư, thu được 500 ml dd B 0,56 lít khí H2
A/ viết các PTPỨ xảy ra và tính nồng độ mol của dd B
B/ tính thể tích dd HCl 0,2M cần dùng để trung hòa 100ml dd B
Hỗn hợp A gồm Na và Na2O, hòa tan hoàn toàn 2,08 gam A vào 1 lượng nước dư, thu được 500 ml dd B 0,56 lít khí H2
A/ viết các PTPỨ xảy ra và tính nồng độ mol của dd B
B/ tính thể tích dd HCl 0,2M cần dùng để trung hòa 100ml dd B
A) có 2 pthh
Na2o + h2o ----> 2Naoh
2Na +2 h2o ------> 2naoh + h2
N khí. H2 = 0,56/22,4 =0,025 (mol)
Gọi x và y lần lượt là số mol của bà và na2o
Viết lại pt
2Na +2 h2o----> 2 naoh + h2
X mol. X/2 moll
Na2o + h2o-----> 2naoh
Xin lỗi bài này có gif đó sai sai xin bí tay
Đúng 0
Bình luận (0)
Cho 0,3 mol bột Cu và 0,6 mol Fe(NO3)2 vào dd chứa 0,9 mol H2SO4 (loãng). Sau khi các pư xảy ra hoàn toàn, thu được V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của V là A. 6,72. B. 8,96. C. 4,48. D. 10,08.
Đọc tiếp
Cho 0,3 mol bột Cu và 0,6 mol Fe(NO3)2 vào dd chứa 0,9 mol H2SO4 (loãng). Sau khi các pư xảy ra hoàn toàn, thu được V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của V là
A. 6,72.
B. 8,96.
C. 4,48.
D. 10,08.
hòa tan hoàn toàn 8.5 gam hỗn hợp K ,Na vào nước thu dc 200ml dd và 3,36 lít khí h2 dktc
a.viết PTHH xảy ra
b.tính nồng độ số mol của dd
a)
$2K + 2H_2O \to 2KOH + H_2$
$2Na + 2H_2O \to 2NaOH + H_2$
b)
Gọi $n_K = a(mol) ; n_{Na} = b(mol) \Rightarrow 39a + 23b = 8,5(1)$
Theo PTHH :
$n_{H_2} = 0,5a + 0,5b = \dfrac{3,36}{22,4} = 0,15(2)$
Từ (1)(2) suy ra a = 0,1 ; b = 0,2
$C_{M_{KOH}} = \dfrac{0,1}{0,2} = 0,5M$
$C_{M_{NaOH}} = \dfrac{0,2}{0,2} = 1M$
Đúng 2
Bình luận (0)
cho hỗn hợp gồm 1,12g Fe và 1,93g Cu vào 400ml dd chứa hh gồm H2SO4 0,5M và NaNO3 0,2M Sau khi các phản ứng xảy ra hoàn toàn , thu được dd X và khí NO.Cho V ml dd NaOH vào dd X thì lượng kết tủa thu được lớn nhất.Giá trị tối thiểu của V là bao nhiêu?
Số mol Fe và Cu lần lượt là 0,02 và 0,03 mol.
3Cu + 8H+ + 2NO3- ---> 3Cu2+ + 2NO + 4H2O
Fe + 4H+ + NO3- ---> Fe3+ + NO + 2H2O
Ta tính được số mol H+ dư là 0,24 mol
Số mol NO3- dư là 0,04 mol.
Vậy trong dung dịch X lúc này có
0,02 mol Fe3+
0,03 mol Cu2+
0,24 mol H+
Vậy lượng NaOH cần dùng là 0,02*3 + 0,03*2 + 0,24*1 = 0,36 mol
Vì không có nồng độ của dung dịch NaOH nên tiếp theo thì... chịu ^^
Đúng 0
Bình luận (0)
Nhỏ từ từ 200ml dd X có chứa HCl 2M và NaHSO4 0,5M vào 100ml dd Y chứa Na2CO3 2M và K2CO3 1M, sau khi phản ứng xảy ra hoàn toàn thu được V lít CO2 và dd Z, nhỏ tiếp Ba(OH)2 đến dư vào dd Z thì thu được m gam kết tủa. Tính V,m ?
Cho 42,8 g hỗn hợp (hh) X gồm R,A,B ở trên vào 250g dd H2SO4 19,6% thu được V lít khí H2 thoát ra (dktc), dd Y và 8,4g chất rắn. Chỉ có R dư. Các pứ xảy ra hoàn toàn.
1, Tính % khối lượng mỗi chất trong X, biết trong hh X số mol A và B bằng nhau.
2, Tính V và tính C% của muối trong dd Y
3, Đun nóng Y trong một thời gian (tg) thu được 152g dd muối có nồng độ 40% và 27g muối kế
Cho 48g Fe2O3 vào bình chứa m (g) dd H2SO4 9,8%( loãng), sau khi pư xảy ra hoàn toàn thu được dd A có khối lượng 474g1. Tính m và nồng độ % các chất tan trong dd A.2. Nếu cho 48g Fe2O3 vào bình chứa m gam dd H2SO4 ( loãng) sauy đó sục SO2 đến dư vào bình đến khi pư xảy ra hoàn toàn thu được dd B. Tính nồng độ % của các chất tan trong dd B ( coi SO2 ko tan trong H2O
Đọc tiếp
Cho 48g Fe2O3 vào bình chứa m (g) dd H2SO4 9,8%( loãng), sau khi pư xảy ra hoàn toàn thu được dd A có khối lượng 474g
1. Tính m và nồng độ % các chất tan trong dd A.
2. Nếu cho 48g Fe2O3 vào bình chứa m gam dd H2SO4 ( loãng) sauy đó sục SO2 đến dư vào bình đến khi pư xảy ra hoàn toàn thu được dd B. Tính nồng độ % của các chất tan trong dd B ( coi SO2 ko tan trong H2O
Cho 48g Fe2O3 vào bình chứa m (g) dd H2SO4 9,8%( loãng), sau khi pư xảy ra hoàn toàn thu được dd A có khối lượng 474g1. Tính m và nồng độ % các chất tan trong dd A.2. Nếu cho 48g Fe2O3 vào bình chứa m gam dd H2SO4 ( loãng) sauy đó sục SO2 đến dư vào bình đến khi pư xảy ra hoàn toàn thu được dd B. Tính nồng độ % của các chất tan trong dd B ( coi SO2 ko tan trong H2O
Đọc tiếp
Cho 48g Fe2O3 vào bình chứa m (g) dd H2SO4 9,8%( loãng), sau khi pư xảy ra hoàn toàn thu được dd A có khối lượng 474g
1. Tính m và nồng độ % các chất tan trong dd A.
2. Nếu cho 48g Fe2O3 vào bình chứa m gam dd H2SO4 ( loãng) sauy đó sục SO2 đến dư vào bình đến khi pư xảy ra hoàn toàn thu được dd B. Tính nồng độ % của các chất tan trong dd B ( coi SO2 ko tan trong H2O
1. Ta có: m dd A = mFe2O3 (pư) + m dd H2SO4
⇒ mFe2O3 (pư) = 474 - m (g) \(\Rightarrow n_{Fe_2O_3\left(pư\right)}=\dfrac{474-m}{160}\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{m.9,8\%}{98}\left(mol\right)\)
PT: \(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
Theo PT: \(n_{H_2SO_4}=3n_{Fe_2O_3}\)
\(\Rightarrow\dfrac{9,8\%m}{98}=3.\dfrac{474-m}{160}\) \(\Rightarrow m=450\left(g\right)\)
\(\Rightarrow n_{H_2SO_4}=0,45\left(mol\right)\)
Theo PT: \(n_{Fe_2O_3}=\dfrac{48}{160}=0,3\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,45}{3}\), ta được Fe2O3 dư.
\(\Rightarrow n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{3}n_{H_2SO_4}=0,15\left(mol\right)\)
\(\Rightarrow C\%_{Fe_2\left(SO_4\right)_3}=\dfrac{0,15.400}{474}.100\%\approx12,66\%\)
2. Sau khi cho 48 (g) Fe2O3 vào 450 (g) dd H2SO4 thu được thì trong bình chứa dd A: 0,15 (mol) Fe2(SO4)3 và 0,15 (mol) Fe2O3 dư.
\(SO_2+Fe_2\left(SO_4\right)_3+2H_2O\rightarrow2H_2SO_4+2FeSO_4\)
0,15________0,15_______________0,3________0,3 (mol)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
0,1___________0,3________0,1 (mol)
\(SO_2+Fe_2\left(SO_4\right)_3+2H_2O\rightarrow2H_2SO_4+2FeSO_4\)
0,1___________0,1______________0,2_________0,2 (mol)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
0,05_________0,15________0,05 (mol)
\(SO_2+Fe_2\left(SO_4\right)_3+2H_2O\rightarrow2H_2SO_4+2FeSO_4\)
_0,05________0,05______________0,1_______0,1 (mol)
⇒ nSO2 = 0,15 + 0,1 + 0,05 = 0,3 (mol)
⇒ m dd B = 48 + 450 + 0,3.64 = 517,2 (g)
Dd B gồm: FeSO4: 0,6 (mol) và H2SO4: 0,15 (mol)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{FeSO_4}=\dfrac{0,6.152}{517,2}.100\%\approx17,63\%\\C\%_{H_2SO_4}=\dfrac{0,15.98}{517,2}.100\%\approx2,84\%\end{matrix}\right.\)
Đúng 1
Bình luận (1)