đốt cháy 21 gam 1 mẫu sắt không tinh khiết trong oxi dư người ta thu được 23,2 gam oxit sắt từ Fe3O4. tính độ tinh khiết của mẫu sắt đã dùng

Những câu hỏi liên quan
đốt cháy 21 gam 1 mẫu sắt không tinh khiết trong oxi dư người ta thu được 23,2 gam oxit sắt từ Fe3O4. tính độ tinh khiết của mẫu sắt đã dùng
giúp mình nhá
PTHH: 3Fe + 2O2 → Fe3O4
Số mol của Fe3O4 là: 23,2 : 232 = 0,1 (mol)
Số mol của Fe là: 0,1 . 3 = 0,3 (mol)
Khối lượng Fe nguyên chất tham gia phản ứng là:
0,3 . 56 = 16,8 gam
% tinh khiết của mẩu sắt là: (16,8:21).100% = 80%
Đúng 0
Bình luận (1)
Ta có PT:
3Fe + 2O2 ---> Fe3O4
n\(Fe_3O_4\)=\(\frac{23,2}{232}\)=0,1(mol)
Theo PT ta có:
nFe tinh khiết = 3n\(Fe_3O_4\)= 3.0,1=0,3(mol)
mFe tinh khiết = 0,3.56 = 16,8(g)
Độ tinh khiết của sắt đã dùng
= \(\frac{16,8}{21}\).100%=80%
đốt cháy 16,8 gam sắt trong không khí thu được 23,2 gam oxit sắt từ (Fe3O4).Tìm khối lượng oxi đã dùng
BTKL: \(m_{O_2}+m_{Fe}=m_{Fe_3O_4}\)
\(\Rightarrow m_{O_2}=23,2-16,8=6,4(g)\)
Đúng 4
Bình luận (0)
Đốt cháy 3,25g một mẫu lưu huỳnh không tinh khiết trong không khí có oxi dư, người ta thu được 2,24 lit khí sunfuro(dktc). Bằng cách nào ta có thể tính được nồng độ tinh khiết của mẫu lưu huỳnh đã dùng?
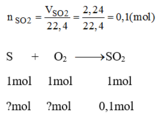
Theo pt: 1 mol S tham gia phản ứng sinh ra 1 mol S O 2
Số mol của lưu huỳnh tham gia phản ứng:
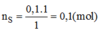
Khối lượng của lưu huỳnh tinh khiết: m S = n S . M S =0,1.32=3,2(g)
Độ tinh khiết của mẫu lưu huỳnh:
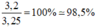
Đúng 0
Bình luận (0)
Đốt cháy 16,8 gam Sắt, sau phản ứng ta thu được 23,2 gam sắt từ oxit ( Fe3O4 ).
a. Tính khối lượng oxi đã tham gia phản ứng.
b. Tìm thành % về khối lượng các nguyên tố trong hợp chất sắt từ oxit ( Fe3O4 ).
Đốt cháy 15 gam một mẫu cacbon không tinh khiết trong khí oxi dư, thu được 17,92 lít khí CO2 (ở đktc). Độ tinh khiết của mẫu cacbon trên là:
Đọc tiếp
Đốt cháy 15 gam một mẫu cacbon không tinh khiết trong khí oxi dư, thu được 17,92 lít khí CO2 (ở đktc). Độ tinh khiết của mẫu cacbon trên là:
\(n_{CO_2}=\dfrac{17,92}{22,4}=0,8\left(mol\right)\)
PT: \(C+O_2\underrightarrow{t^o}CO_2\)
Theo PT: \(n_C=n_{CO_2}=0,8\left(mol\right)\)
\(\Rightarrow m_C=0,8.12=9,6\left(g\right)\)
Độ tinh khiết của mẫu C là: \(\dfrac{9,6}{15}.100\%=64\%\)
Đúng 2
Bình luận (0)
. Áp dụng định luật bảo toàn khối lượng tính khối lượng các chất trong từng phản ứng dưới đây:
a/ Đốt cháy 16,8 gam sắt trong bình đựng oxi thu được 23,2 gam oxit sắt từ Fe3O4. Tính khối lượng oxi đã tham gia phản ứng.
\(a,BTKL:m_{Fe}+m_{O_2}=m_{Fe_3O_4}\\ \Rightarrow m_{O_2}=m_{Fe_3O_4}-m_{Fe}=23,2-16,8=6,4(g)\)
Đúng 2
Bình luận (0)
13/ đốt cháy 21g một mẫu sắt không tinh khiết trong oxi dư ng ta thu đc 23,2g oxit sắt từ Fe3O4. tính độ tinh khiết của mẫu sắt đã dùng
16/ tính số mol khí sunfuro sinh ra trong mỗi trường hợp sau
a/ có 1,5 mol khí oxi tham gia phản ứng vs S
b/ đốt cháy hoàn toàn 38,4g S trong khí oxi.
13) \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
\(n_{Fe_3O_4}=\frac{23,2}{232}=0,1mol\)
\(n_{Fe}=3.n_{Fe_3O_4}=3.0,1=0,3mol\)
\(m_{Fe\left(tinhkhiết\right)}=0,3.56=16,8g\)
Độ tinh khiết là: \(\frac{16,8}{21}.100\left(\%\right)=80\%\)
Đúng 0
Bình luận (0)
16) a) S+O2=to=>SO2
\(n_{O_2}=n_{SO_2}=1,5mol\)
b) S+O2=to=>SO2
\(n_S=\frac{38,4}{32}=1,2mol\)
\(n_{SO_2}=n_S=1,2mol\)
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 16,8 gam sắt trong không khí lấy dư.
a, viết PTHH
b, tính thể tích khí oxi (đktc) đã dùng?
c, tính khối lượng oxit sắt từ (Fe3O4) thu được?
\(n_{Fe}=\dfrac{16.8}{56}=0.3\left(mol\right)\)
\(3Fe+2O_2\underrightarrow{t^0}Fe_3O_4\)
\(0.3......0.2.........0.1\)
\(V_{O_2}=0.2\cdot22.4=4.48\left(l\right)\)
\(m_{Fe_3O_4}=0.1\cdot232=23.2\left(g\right)\)
Đúng 2
Bình luận (0)
Đốt cháy 3,25 g một mẫu lưu huỳnh không tinh khiết trong khí oxi dư , người ta thu được 2,24 lít khí sunfurơ (đktc)
a) VIết phương trình hóa học
b) Bằng cách nào ta có thể tính được độ tinh khiết của mẫu lưu huỳnh đã dùng
c) Căn cứ vào PTHH trên , ta có thể trả lời ngay được thể tích khí oxi (đktc) vừa đủ để đốt cháy lưu huỳnh là bào nhiêu lít
a) S + O2 \(\rightarrow\) SO2
b) Tính độ tinh khiết bằng cách lấy lượng lưu huỳnh tinh khiết(tức là lượng lưu huỳnh tham gia phản ứng ) chia cho lượng lưu huỳnh đề bài cho nhân với 100% . Mình giải luôn nhé!
nSO2 = V/22,4 = 2,24/22,4 =0,1(mol)
Theo PT => nS = nSO2 = 0,1(mol)
=> mS(tinh khiết) = n .M = 0,1 x 32 = 3,2(g)
=> độ tinh khiết của mẫu lưu huỳnh đã dùng = mS(tinh khiết) : mS(ĐB) x 100% = 3,2/3,25 x 100% =98,46%
c) Theo PT thấy nO2 = nSO2
mà số mol = nhau dẫn đến thể tích cũng bằng nhau
=> VO2 = VSO2 = 2,24(l)
Đúng 1
Bình luận (0)





















