Cho các phản ứng sau: SO2 + Na2CO3 Na2SO3 + CO2 ↑; SO2 + Mg MgO + S; SO2 + Na2SO3 + H2O NaHSO3; SO2 + KMnO4 + H2O MnSO4 + K2SO4 + H2SO4 Tổng số phản ứng mà SO2 đóng vai trò là chất khử là

Những câu hỏi liên quan
Lập các phương trình hoá học sau ( ghi rõ điều kiện phản ứng nếu có) và cho biết phản ứng đó là phản ứng gì a, Cu+O2—>CuO b, Na+H2O—->NaOH+H2 c, KNO3—>kNO2 +O2
a) \(Cu+O_2\underrightarrow{t^o}2CuO\)
b) \(2Na+2H_2O\rightarrow2NaOH+H_2\)
c) \(2KNO_3\underrightarrow{t^o}2KNO_2+O_2\)
Chúc bạn học tốt
Đúng 6
Bình luận (1)
nhận biết các dung dịch sau:
a, NA2SO4,NA2CO3,MgSO4,AlCl3,CUSO4
b,NA2CO3,MgCl2,AlCl3
c, NA2S,NA2CO3,NA2SO4,NA2SO3
d,SO2,SO3,CO2
a)nếu có hiện tượng kết tủa trắng thì đó là Na2SO4
N1 đem nung kết tủa nhận ra BaCO3 vì xuất hiện khí CO2 -->Na2CO3
+ lấy mẫu thử của các chất rồi cho từng chất đôi một tác dụng với nhau, lập bảng ra xong oy nhận xét:
----chất tạo kết tủa với 2 chất khác--->MgS04
+Lỗ nào xuất hiện kết tủa màu trắng sau đó tan ra với lượng dư NaOH là AlCl3
cho HCl vao` ket tua? tao ra o? 2cap chat tren => ket tua nao` bi tan thi` do la` Cu(OH)2 => cap CuSO4 va` NaOH => cap con lai la` CuSO4 va` BaCl2.
Thôi mk chỉ lắm
Đúng 0
Bình luận (1)
Bài 1: Cho 65g kim loại kẽm tác dụng vs 70g axit clohidric thu được mỗi kẽm clorua và khí hidro a) Lập phương trình hoá học của phản ứng b) Cho bt tỉ lệ số nguyên tử,phân tử giữa các chất trog phản ứng C) Tính khối lượng của kẽm clorua , biết rằng sau phản ứng tạo thành 20g khí hidro
Đọc tiếp
Bài 1: Cho 65g kim loại kẽm tác dụng vs 70g axit clohidric thu được mỗi kẽm clorua và khí hidro a) Lập phương trình hoá học của phản ứng b) Cho bt tỉ lệ số nguyên tử,phân tử giữa các chất trog phản ứng C) Tính khối lượng của kẽm clorua , biết rằng sau phản ứng tạo thành 20g khí hidro
\(a,PTHH:Zn+2HCl\to ZnCl_2+H_2\\ b,\text{Số nguyên tử Zn : Số phân tử }HCl : \text{Số phân tử }ZnCl_2 : \text{Số phân tử }H_2=1:2:1:1\\ c,BTKL:m_{Zn}+m_{HCl}=m_{ZnCl_2}+m_{H_2}\\ \Rightarrow m_{ZnCl_2}=65+70-20=115(g)\)
Đúng 2
Bình luận (0)
nung nóng 66,22g Pb(NO3)2 sau 1 thời gian thu được 55,4g chất rắn a)tính hiệu suất phản ứng b)tính thể tích các khí thu được
a)
$2Pb(NO_3)_2 \xrightarrow{t^o}2 PbO + 4NO_2 + O_2$
Gọi $n_{PbO} =n_{Pb(NO_3)_2\ pư} = a(mol)$
Suy ra:
$66,22 - 331a + 223a = 55,4 \Rightarrow a = 0,1$
$\%H = \dfrac{0,1.331}{66,22}.100\% = 50\%$
Theo PTHH :
$n_{NO_2} = 4a = 0,4(mol) \Rightarrow V_{NO_2} = 0,4.22,4 = 8,96(lít)$
$n_{O_2} = 0,5a = 0,05(mol) \Rightarrow V_{O_2} = 0,05.22,4 = 1,12(lít)$
Đúng 2
Bình luận (1)
Cân bằng các phương trìnha) Fe+HCL -- FeCl2 + H2b) FeS2 + O2 -- SO2 + Fe2O3c) Al + O2 -- Al2O3d)BaCl2 + Na2SO4 -- BaSO4 + NaCle)SO2 + NaOH -- Na2SO3 + H2Og)NaHCO3 + HSO -- Na2SO4 + CO2 + H2Oh)NaHCO3 + NaOH -- Na2CO3 + H2Oi)Fe3O4 + HCl -- FeCl2 + FeCl3 + H2Ok)Fe3O4 + HNO3 -- Fe(NO3)3 + NO + H2Ol)FeS2 + H2SO4 -- Fe2(SO4)3 + SO2 + H2O
Đọc tiếp
Cân bằng các phương trình
a) Fe+HCL --> FeCl2 + H2
b) FeS2 + O2 --> SO2 + Fe2O3
c) Al + O2 --> Al2O3
d)BaCl2 + Na2SO4 --> BaSO4 + NaCl
e)SO2 + NaOH --> Na2SO3 + H2O
g)NaHCO3 + HSO --> Na2SO4 + CO2 + H2O
h)NaHCO3 + NaOH --> Na2CO3 + H2O
i)Fe3O4 + HCl --> FeCl2 + FeCl3 + H2O
k)Fe3O4 + HNO3 --> Fe(NO3)3 + NO + H2O
l)FeS2 + H2SO4 --> Fe2(SO4)3 + SO2 + H2O
a) Fe + 2HCl → FeCl2 + H2
b) 4FeS2 + 11O2 → 8SO2 + 2Fe2O3
c) 4Al + 3O2 → 2Al2O3
d) BaCl2 + Na2SO4 → BaSO4 + 2NaCl
e) SO2 + 2NaOH → Na2SO3 + H2O
g) 2NaHCO3 + H2SO4 → Na2SO4 + 2CO2 + 2H2O
h) NaHCO3 + NaOH → Na2CO3 + H2O
i) Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
k) 3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
l) 2FeS2 + 14H2SO4 → Fe2(SO4)3 + 15SO2 + 14H2O
Đúng 2
Bình luận (2)
a) Fe+2HCL --> FeCl2 + H2
b) 4FeS2 + 11O2 --> 8SO2 + 2Fe2O3
c) 4Al + 3O2 --> 2Al2O3
d)BaCl2 + Na2SO4 --> BaSO4 + 2NaCl
e)SO2 + 2NaOH --> Na2SO3 + H2O
g)2NaHCO3 + H2SO4 --> Na2SO4 + 2CO2 + 2H2O
h)NaHCO3 + NaOH --> Na2CO3 + H2O
i)Fe3O4 + 8HCl --> FeCl2 + 2FeCl3 + 4H2O
k)3Fe3O4 + 28HNO3 --> 9Fe(NO3)3 + NO + 14H2O
l)2FeS2 + 14H2SO4 --> Fe2(SO4)3 + 15SO2 + 14H2O
Đúng 2
Bình luận (0)
Mình chỉ ghi hệ số thôi nha
a)1,2,1,1
b)4,11,8,2
c)4,3,2
d)1,1,1,2
e)1,2,1,1
g)2,1,1,2,2
h)1,1,1,1
i)1,8,1,2,4
k)3,28,9,1,14
l)2,14,1,15,14
Đúng 0
Bình luận (0)
Hỗn hợp R gồm axit oleic và triglixetit X tỉ lệ mol tương ứng là 2:1. Cho m(g) hhR tác dụng với dd brom dư thì có 48g brom tham gia phản ứng. Nếu cho m(g) hhR tác dụng hết với ddNaOH thì sau phản ứng thu được 146,8g hỗn hợp gồm hai muối natrioleat và natripanmtat. Tìm % khối lượng O trong phân tử X?
Trong phòng thí nghiệm, bộ dụng cụ vẽ dưới đây có thể dùng điều chế bao nhiêu khí trong số các khí sau: Cl2, NH3, SO2, CO2, H2, C2H4 (các điều kiện phản ứng có đủ) A. 2. B. 5. C. 4. D. 3.
Đọc tiếp
Trong phòng thí nghiệm, bộ dụng cụ vẽ dưới đây có thể dùng điều chế bao nhiêu khí trong số các khí sau: Cl2, NH3, SO2, CO2, H2, C2H4 (các điều kiện phản ứng có đủ)
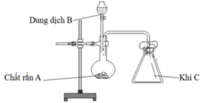
A. 2.
B. 5.
C. 4.
D. 3.
Đáp án D
Để điều chế được khí C theo bộ dụng cụ vẽ trên thì khí C phải thỏa mãn 2 điều kiện:
nặng hơn không khí và không tác dụng với N2, O2 (thành phần chủ yếu của không khí).
Vậy có Cl2, SO2 và CO2 thỏa mãn.
Các phương trình điều chế:
MnO2 r + 4HCl dd → MnCl2 + Cl2 + 2H2O.
Na2SO3 r + H2SO4 dd → Na2SO4 + SO2 + H2O.
CaCO3 r + 2HCl dd → CaCl2 + CO2 + H2O.
Đúng 0
Bình luận (0)
Trong phòng thí nghiệm, bộ dụng cụ vẽ dưới đây có thể dùng điều chế bao nhiêu khí trong số các khí sau: Cl2, NH3, SO2, CO2, H2, C2H4 (các điều kiện phản ứng có đủ) A. 2. B. 5. C. 4. D. 3.
Đọc tiếp
Trong phòng thí nghiệm, bộ dụng cụ vẽ dưới đây có thể dùng điều chế bao nhiêu khí trong số các khí sau: Cl2, NH3, SO2, CO2, H2, C2H4 (các điều kiện phản ứng có đủ)
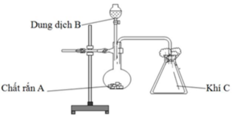
A. 2.
B. 5.
C. 4.
D. 3.
Đáp án D
Để điều chế được khí C theo bộ dụng cụ vẽ trên thì khí C phải thỏa mãn 2 điều kiện:
nặng hơn không khí và không tác dụng với N2, O2 (thành phần chủ yếu của không khí).
Vậy có Cl2, SO2 và CO2 thỏa mãn.
Các phương trình điều chế:
MnO2 r + 4HCl dd → MnCl2 + Cl2 + 2H2O.
Na2SO3 r + H2SO4 dd → Na2SO4 + SO2 + H2O.
CaCO3 r + 2HCl dd → CaCl2 + CO2 + H2O.
Đúng 0
Bình luận (0)
Trong phòng thí nghiệm, bộ dụng cụ vẽ dưới đây: Thí nghiệm trên có thể dùng điều chế bao nhiêu khí trong số các khí sau: Cl2, NH3, SO2, CO2, H2, C2H4 (các điều kiện phản ứng có đủ). A. 2 B. 5 C. 4 D. 3.
Đọc tiếp
Trong phòng thí nghiệm, bộ dụng cụ vẽ dưới đây:
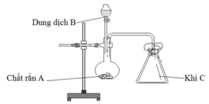
Thí nghiệm trên có thể dùng điều chế bao nhiêu khí trong số các khí sau: Cl2, NH3, SO2, CO2, H2, C2H4 (các điều kiện phản ứng có đủ).
A. 2
B. 5
C. 4
D. 3.
Chọn D.
Khí C thu bằng cách đẩy không khí, ngửa bình nên C phải nặng hơn không khí (loại NH3, H2, C2H4).
Cl2: dung dịch HCl đặc + MnO2 rắn
SO2: dung dịch H2SO4 đặc + Na2SO3 rắn
CO2: dung dịch HCl + CaCO3 rắn
Đúng 0
Bình luận (0)




















