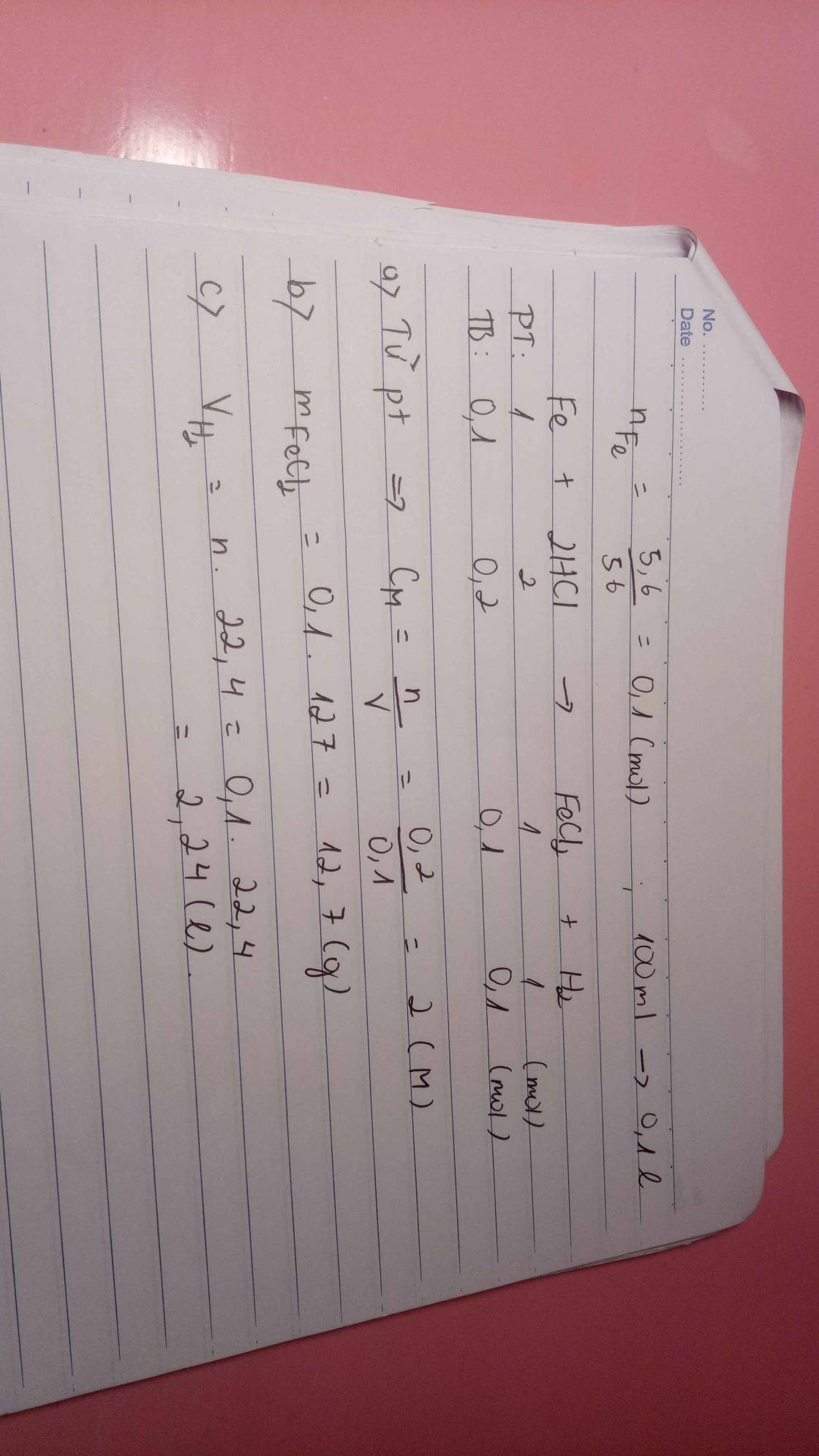Giúp mình giải mẫu Cho 7.3 g HCl vào 100ml nước. Xác định nồng độ các ion trong dùng dịch thu được

Những câu hỏi liên quan
Giúp mình giải mẫu 2 bài này xác định nồng độ các ion Trộn 100 ml dung dikch HCL 0.1M với 300ml dung dịch HCl 0.04M Trộn 100ml dung dịch HNO3 0.1M với 400ml dung dịch H2SO4 0.03M
Trộn 100 ml dung dikch HCL 0.1M với 300ml dung dịch HCl 0.04M
\(n_{HCl}=0,1.0,1=0,01\left(mol\right);n_{HCl}=0,3.0,04=0,012\left(mol\right)\)
Dung dịch gồm H+ và Cl-
\(n_{H^+}=0,01+0,012=0,022\left(mol\right)\)
=> \(\left[H^+\right]=\dfrac{0,022}{0,4}=0,055M\)
\(n_{Cl^-}=0,01+0,012=0,022\left(mol\right)\)
=>\(\left[Cl^-\right]=\dfrac{0,022}{0,4}=0,055M\)
Trộn 100ml dung dịch HNO3 0.1M với 400ml dung dịch H2SO4 0.03M
\(n_{HNO_3}=0,1.0,1=0,01\left(mol\right);n_{H_2SO_4}=0,04.0,3=0,012\left(mol\right)\)
Dung dịch sau khi trộn gồm :
\(n_{H^+}=0,01+0,012.2=0,034\left(mol\right)\)
=> \(\left[H^+\right]=\dfrac{0,034}{0,5}=0,068M\)
\(n_{NO_3^-}=0,01\left(mol\right)\)
=>\(\left[NO_3^-\right]=\dfrac{0,01}{0,5}=0,02M\)
\(n_{SO_4^{2-}}=0,012\left(mol\right)\)
=> \(\left[SO_4^{2-}\right]=\dfrac{0,012}{0,5}=0,024M\)
Đúng 2
Bình luận (0)
Hòa tan 10.6 g Na2CO3 vào 200g dung dịch HCl 7.3% thu được dung dịch A và khí B( đktc).
a, tìm thể tích khí B
b, xác định nồng độ % các chất có trong dung dịch A
PTHH: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
Số mol của Na2CO3 là: 10,6 : 106 = 0,1 (mol)
Khối lượng của HCl là: 200 . 7,3% = 14,6 gam
Số mol của HCl là: 14,6 : 36,5 = 0,4 (mol)
So sánh: 0,1 < 0,4 : 2
=> HCl dư. Tính theo Na2CO3
a) Số mol của CO2 là: 0,1 mol
Thể tích CO2 sinh ra là: 0,1 . 22,4 = 2,24 lít
b) Khối lượng dung dịch A là:
10,6 + 200 - 0,1 .44 = 206,2 gam
Khối lượng NaCl là: 0,2 . 58,5 = 11,7 gam
%NaCl trong dung dịch A là: (11,7:206,2).100%=5,68%
Đúng 1
Bình luận (0)
Cho 5,6g Fe phản ứng hoàn toàn với 100ml dung dịch HCl phản ứng xảy ra hoàn toàn a. Xác định nồng độ dung dịch HCl cần dùng b. Xác định khối lượng muối thu được sau phản ứng c. Xác định thể tích Hidro thu được sau phản ứng
Để giải bài toán này, ta cần biết phương trình phản ứng giữa Fe và HCl: Fe + 2HCl -> FeCl2 + H2 a. Để xác định nồng độ dung dịch HCl cần dùng, ta cần tính số mol của Fe. Đầu tiên, ta cần chuyển khối lượng Fe thành số mol bằng cách sử dụng khối lượng mol của Fe (56g/mol): Số mol Fe = khối lượng Fe / khối lượng mol Fe = 5,6g / 56g/mol = 0,1 mol Vì theo phương trình phản ứng, 1 mol Fe tương ứng với 2 mol HCl, nên số mol HCl cần dùng là gấp đôi số mol Fe: Số mol HCl = 2 x số mol Fe = 2 x 0,1 mol = 0,2 mol Để tính nồng độ dung dịch HCl, ta chia số mol HCl cho thể tích dung dịch HCl: Nồng độ HCl = số mol HCl / thể tích dung dịch HCl = 0,2 mol / 0,1 L = 2 mol/L Vậy, nồng độ dung dịch HCl cần dùng là 2 mol/L. b. Để xác định khối lượng muối thu được sau phản ứng, ta cần tính số mol muối FeCl2. Theo phương trình phản ứng, 1 mol Fe tương ứng với 1 mol FeCl2, nên số mol muối FeCl2 cũng là 0,1 mol. Khối lượng muối FeCl2 = số mol muối FeCl2 x khối lượng mol muối FeCl2 = 0,1 mol x (56g/mol + 2 x 35,5g/mol) = 0,1 mol x 127g/mol = 12,7g Vậy, khối lượng muối thu được sau phản ứng là 12,7g. c. Để xác định thể tích Hidro thu được sau phản ứng, ta cần tính số mol H2. Theo phương trình phản ứng, 1 mol Fe tương ứng với 1 mol H2, nên số mol H2 cũng là 0,1 mol. Thể tích H2 = số mol H2 x thể tích mol của H2 = 0,1 mol x 22,4 L/mol = 2,24 L Vậy, thể tích Hidro thu được sau phản ứng là 2,24 L.
Đúng 1
Bình luận (0)
a, \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{HCl}=2n_{Fe}=0,2\left(mol\right)\Rightarrow C_{M_{HCl}}=\dfrac{0,2}{0,1}=2\left(M\right)\)
b, \(n_{FeCl_2}=n_{H_2}=n_{Fe}=0,1\left(mol\right)\)
\(\Rightarrow m_{FeCl_2}=0,1.127=12,7\left(g\right)\)
c, \(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
Đúng 1
Bình luận (0)
Hoà tan 1,17 gam nacl vào 2,08 gam BaCl2 vào nước thu được 100ml dd X.Tính nồng độ mol các ion trong dung dịch X
\(n_{NaCl}=\dfrac{1,17}{58,5}=0,02\left(mol\right)\\ n_{BaCl_2}=\dfrac{2,08}{208}=0,01\left(mol\right)\\ \left[Na^+\right]=\dfrac{0,02}{0,1}=0,2\left(M\right)\\ \left[Ba^{2+}\right]=\dfrac{0,01}{0,1}=0,1\left(M\right)\\ \left[Cl^-\right]=\dfrac{0,02+0,01.2}{0,1}=0,4\left(M\right)\)
Đúng 2
Bình luận (0)
Khi cho 100ml dung dịch KOH 1M vào 100ml dung dịch HCl thu được dung dịch có chứa 6,525 gam chất tan. Nồng độ mol của HCl trong dung dịch đã dùng là
A. 0,75M
B. 1M
C. 0,25M
D. 0,5M
Đáp án D
Gọi số mol HCl là x mol
HCl + KOH → KCl + H2O
x x (mol)
Giả sử KOH hết ⇒ mKCl = 74,5 . 0,1 = 7.45(g) > 6,525 ⇒KOH dư ,HCl hết.
(0,1 - x).56 + x.(39 + 35,5) = 6,525
⇒ x = 0,05 mol ⇒ CM = 0,5M
Đúng 0
Bình luận (0)
Để xác định nồng độ của dung dịch NaOH ta thực hiện phương pháp chuẩn độ như sau:- Dùng pipete lấy 10ml dung dịch HCl 0,1M (dung dịch chuẩn) cho vào bình tam giác 100ml, thêm 1 - 2 giọt phnolphthalein- Cho dung dịch NaOH cần xác định nồng độ vào burete, điều chỉnh dung dịch trong burete về mức 0- Mở khóa burete, nhỏ từng giọt dung dịch NaOH xuống bình tam giác (lắc đều trong quá trình chuẩn độ) đến khi dung dịch trong bình tam giác từ không màu chuyển sang màu hồng nhạt (bền trong khoảng 10 giây...
Đọc tiếp
Để xác định nồng độ của dung dịch NaOH ta thực hiện phương pháp chuẩn độ như sau:
- Dùng pipete lấy 10ml dung dịch HCl 0,1M (dung dịch chuẩn) cho vào bình tam giác 100ml, thêm 1 - 2 giọt phnolphthalein
- Cho dung dịch NaOH cần xác định nồng độ vào burete, điều chỉnh dung dịch trong burete về mức 0
- Mở khóa burete, nhỏ từng giọt dung dịch NaOH xuống bình tam giác (lắc đều trong quá trình chuẩn độ) đến khi dung dịch trong bình tam giác từ không màu chuyển sang màu hồng nhạt (bền trong khoảng 10 giây) thì ngừng chuẩn độ.
- Ghi lại thể tích dung dịch NaOH đã dùng là 10,2 ml
Vậy nồng độ của dung dịch NaOH là bao nhiêu ?
\(NaOH+HCl\rightarrow NaCl+H_2O\)
Ta có : \(n_{NaOH}=n_{HCl}\Leftrightarrow C_{MNaOH}.V_{NaOH}=C_{MHCl}.V_{HCl}\)
\(\Rightarrow C_{MNaOH}=\dfrac{C_{MHCl}.V_{HCl}}{V_{NaOH}}=\dfrac{0,1.0,01}{0,0102}\simeq0,1l=100ml\)
Đúng 2
Bình luận (1)
Cho 100ml dung dịch KOH 1M vào 100ml dung dịch HCl thu được dung dịch có chứa 6,525 gam chất tan. Nồng độ mol của dung dịch HCl đã dùng là
A. 1 M
B. 0,5 M
C. 0,75M
D. 0,25M
Đáp án : B
+) TH1 : Dung dịch sau có KCl và KOH dư
=> nKCl = nHCl = x mol ; nKOH dư = 0,1 – x
=> mchất tan = 74,5x + 56(0,1 – x) = 6,525g
=> x = 0,05 mol => CM(HCl) = 0,5M
Không cần xét TH HCl dư
Đúng 0
Bình luận (0)
Xác định nồng độ phần trăm của dung dịch thu được khi cho 14 gam KOH vào 160ml nước (d=1g/ml).
Giải giúp mình với T-T
\(C\%_{ddKOH}=\dfrac{14}{14+1.160}.100\approx8,046\%\)
Đúng 1
Bình luận (0)
Khi cho 100ml dung dịch KOH 1M vào 100mk dung dịch HCl thu được dung dịch có chứa 6,525g chất tam. Nồng độ mol của HCl trong dung dịch đã dùng là bao nhiêu
$KOH + HCl \to KCl + H_2O$
Giả sử $KOH$ hết
$n_{KCl} = n_{KOH} = 0,1.1 = 0,1(mol)$
$m_{KCl} =0,1.74,5 = 7,45(gam) > 6,525(gam)$
Suy ra $KOH$ dư. Gọi $C_{M_{HCl}} = a(M)$
Theo PTHH :
$n_{KOH\ pư} = n_{KCl} = n_{HCl} = 0,1a(mol)$
Suy ra :
$(0,1 - 0,1a).56 + 0,1a.74,5 = 6,525 \Rightarrow a = 0,5(M)$
Đúng 1
Bình luận (2)
Cách 2 : $n_{K^+} = n_{OH^-} = n_{KOH} = 0,1(mol)$
$C_{M_{HCl} } = aM \Rightarrow n_{H^+} = n_{Cl^-} = n_{HCl} = 0,1a(mol)$
Chứng minh KOH dư tương tự cách trên.
OH- + H+ → H2O
0,1a.......0,1a......................(mol)
Dung dịch sau phản ứng gồm :
$OH^- : 0,1 -0,1a(mol)$
$K^+ : 0,1(mol)$
$Cl^- : 0,1a(mol)$
Suy ra: $(0,1- 0,1a).17 + 0,1.39 + 0,1a.35,5 = 6,525 \Rightarrow a = 0,5$
Đúng 1
Bình luận (0)