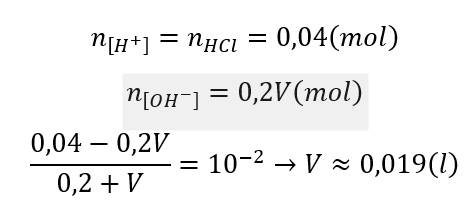Tính pH của các dung dịch sau:
a) dung dịch HCl 0,1 M
b) dung dịch Ba(OH)2 0,2M

Những câu hỏi liên quan
Trộn dung dịch HCl 0,2M và dung dịch Ba(OH)2 0,2M có V bằng nhau. pH của dung dịch thu được là:
A. 12,5
B. 5
C. 13
D. 11,2
Đáp án C
2 dung dịch có thể tích bằng nhau ⇒ nOH-/ Ba(OH)2 = 2nH+/ HCl
H+ + OH- → H2O
0,2V 0,4V (mol)
Phản ứng : 0,2V → 0,2V (mol)
⇒ Trong dung dịch thu được có OH- dư
Trộn 2 dung dịch có cùng thể tích ⇒ [OH-] dư = 0,2 : 2 = 0,1M
⇒ pH = 13.
Đáp án C.
Đúng 0
Bình luận (0)
Tính pH của các dung dich sau:
a. Dung dịch Ba(OH)2 nồng độ 0,02M
b. Dung Dich HCl nồng độ 0,02M
Trộn dung dịch HCl 0,2M và dung dịch Ba(OH)2 0,2M có V bằng nhau . pH của dung dịch thu được là ?
2 dung dịch có thể tích bằng nhau ⇒ nOH-/ Ba(OH)2 = 2nH+/ HCl
H+ + OH- → H2O
0,2V 0,4V (mol)
Phản ứng : 0,2V → 0,2V (mol)
⇒ Trong dung dịch thu được có OH- dư
Trộn 2 dung dịch có cùng thể tích ⇒ [OH-] dư = 0,2 : 2 = 0,1M
⇒ pH = 13.
trộn 200ml dung dịch HCl 0,2M với V lít dung dịch Y gồm KOH 0,1M và Ba(OH)2 0,05M . Dung dịch có pH=2 . Tính V?
Trộn 100 ml dung dịch NaOH 0,2M với 400 ml dung dịch Ba(OH)2 0,1M thu được dung dịch A. Tính pH dung dịch A Cho 500 ml dung dịch HCl 0,3 M vào 500 ml dung dịch A thu được dung dịch B. Tính pH dung dịch B
Trộn 100ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M thu được dung dịch X. Tính pH của dung dịch X? A. 8 B. 14 C. 12 D. 13
Đọc tiếp
Trộn 100ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M thu được dung dịch X. Tính pH của dung dịch X?
A. 8
B. 14
C. 12
D. 13
Đáp án C
nH+ = 0,02 mol; nOH-= 0,04 mol
H+ + OH- → H2O
0,02 0,04
nOH- dư = 0,02 mol; [OH-] dư = 0,02/0,2 = 0,1M suy ra [H+] = 10-13 M suy ra pH = 13
Đúng 0
Bình luận (0)
Cho 0,1 lít dung dịch X gồm HNO3 0,1M và HCl 0,2M tác dụng với V lít dung dịch Y gồm Ba(OH)2 0,05M và NaOH 0,2M, thu được dung dịch Z có pH = 13. Giá trị của V là: (Cho H = 1; N = 14; O = 16; Cl = 35,5; Ba = 137; Na = 23) A. 0,4. B. 0,2. C. 0,225. D. 0,25.
Tính pH của:
a) Dung dịch HCl 0,01 M
b) Dung dịch Ba(OH)2 0,01M
\(pH=-log\left[H^+\right]=-log\left(0.01\right)=2\)
\(pH=14+log\left[OH^-\right]=14+log\left(0.01\cdot2\right)=12.3\)
Đúng 2
Bình luận (0)
Câu 1: Trộm 600 ml dung dịch HNO3 0,1 M với 400 ml dung dịch Ba(OH)2 0,05M thu được dung dịch X. Coi như thể tích dung dịch thay đổi không đáng kể. Tổng nồng độ mol của các cation trong X là bao nhiêu ?Câu 2: Trộm 200 ml dung dịch HCl 0,2M với 300 ml dung dịch H2SO4 0,1M thu được dung dịch X. Coi như thể tích dung dịch thay đổi không đáng kể, tổng nồng độ mol của các cation trong X là bao nhiêu ?
Đọc tiếp
Câu 1: Trộm 600 ml dung dịch HNO3 0,1 M với 400 ml dung dịch Ba(OH)2 0,05M thu được dung dịch X. Coi như thể tích dung dịch thay đổi không đáng kể. Tổng nồng độ mol của các cation trong X là bao nhiêu ?
Câu 2: Trộm 200 ml dung dịch HCl 0,2M với 300 ml dung dịch H2SO4 0,1M thu được dung dịch X. Coi như thể tích dung dịch thay đổi không đáng kể, tổng nồng độ mol của các cation trong X là bao nhiêu ?
\(1.n_{cation}=0,1.0,6+0,05.0,4=0,08\left(mol\right)\\ C_{M\left(cation\right)}=\dfrac{0,08}{0,6+0,4}=0,08\left(M\right)\\ 2.n_{cation}=0,2.0,2+2.0,3.0,1=0,1mol\\ C_{M\left(cation\right)}=\dfrac{0,1}{0,2+0,3}=0,2\left(M\right)\)
Đúng 1
Bình luận (1)
Câu 1:
Dung dịch HNO3 có nồng độ 0,1 M và thể tích 600 ml, vậy số mol HNO3 là: 0,1 * 0,6 = 0,06 mol.
Dung dịch Ba(OH)2 có nồng độ 0,05 M và thể tích 400 ml, vậy số mol Ba(OH)2 là: 0,05 * 0,4 = 0,02 mol.
Tổng số mol các cation trong dung dịch X là: 0,06 + 0,02 = 0,08 mol.
Câu 2:
Dung dịch HCl có nồng độ 0,2 M và thể tích 200 ml, vậy số mol HCl là: 0,2 * 0,2 = 0,04 mol.
Dung dịch H2SO4 có nồng độ 0,1 M và thể tích 300 ml, vậy số mol H2SO4 là: 0,1 * 0,3 = 0,03 mol.
Tổng số mol các cation trong dung dịch X là: 0,04 + 0,03 = 0,07 mol.
Đúng 0
Bình luận (2)