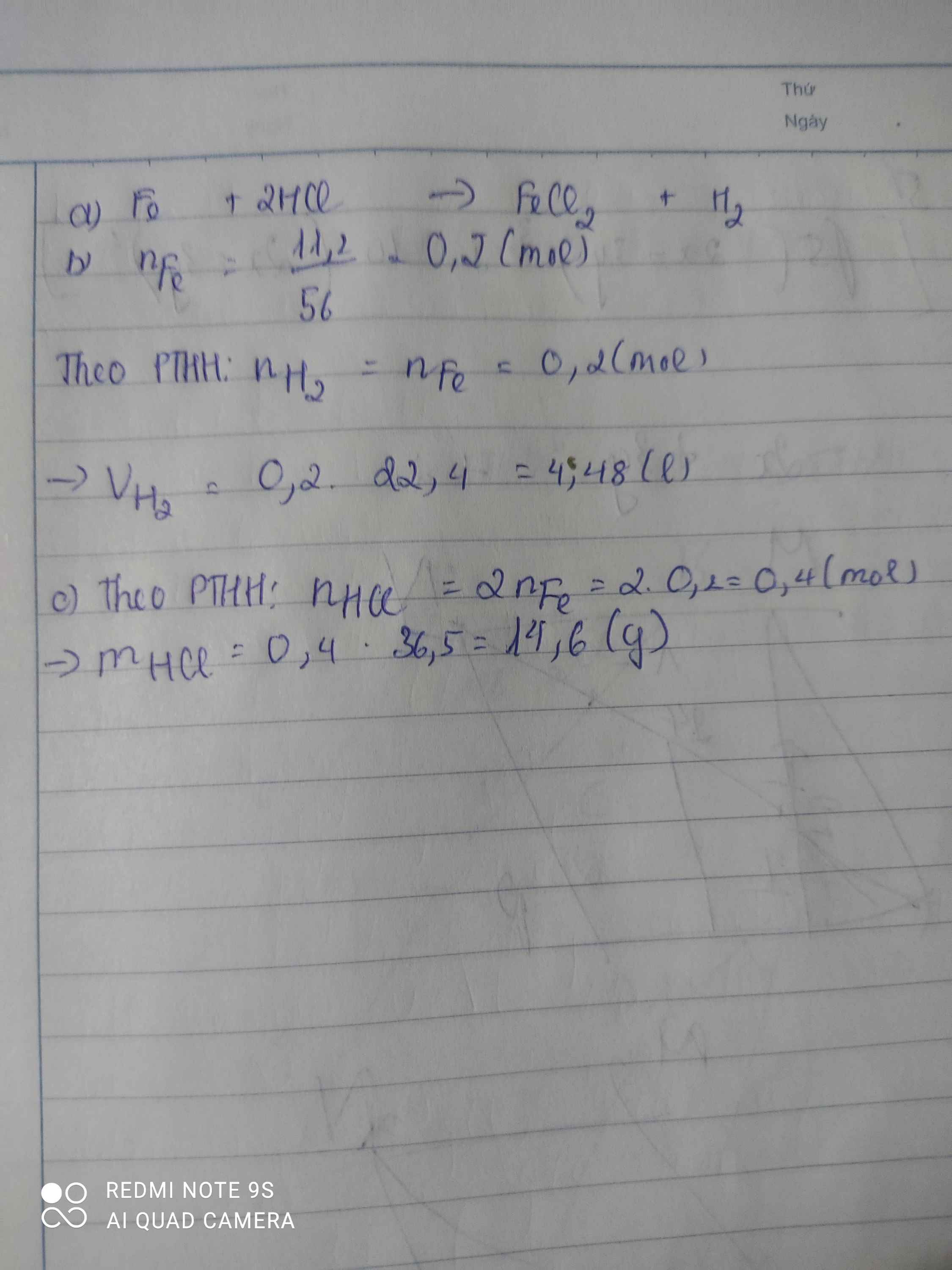cho 112g sắt tác dụng vs dd axit clohidric (HCL) tạo ra 254 g sắt(ll) clourua (FeCl2) và 4g khí H bay lên .tính khối lượng axit clohidric đã dùng

Những câu hỏi liên quan
Cho 14g sắt tác dụng vừa đủ với axit clohidric (HCl) tạo ra muối sắt ll clorua ( FeCl2) và khí hidro - lập phương trình hoá học - tính thể tích khí Hidro thoát ra ở điều kiện tiêu chuẩn - tính khối lượng axit clohdric(HCl) đã dùng cho phản ứng ?
\(Fe+2HCl\rightarrow FeCl_2+H_2\\ n_{Fe}=\dfrac{14}{56}=0,25\left(mol\right)\\ n_{H_2}=n_{Fe}=0,25\left(mol\right)\\ V_{H_2}=0,25.22,4=5,6\left(l\right)\\ n_{HCl}=2n_{Fe}=0,5\left(mol\right)\\ m_{HCl}=0,5.36,5=18,25\left(g\right)\)
Đúng 2
Bình luận (0)
cho 112g Fe TÁC DỤNG VỚI DUNG DỊCH AXIT CLOHIDRIC hcl tạo ra 254g sắt(2) clorua FeCl2 và 4g khí hidro
a/ tinh kl axitclohidric đã phản ứng
b/ tính số phân tử axit clohidric
PTHH: Fe + 2HCl → FeCl2 + H2
=> mFe + mHCl = mFeCl2 + mH2
112 + mHCl = 254 +5
112 + mHCl = 258
mHCl = 258 - 112
mHCl = 146
Vậy KL của axit clohidric khi tham gia phản ứng là 146(g)
Đúng 1
Bình luận (0)
9/ Cho 5,6g sắt (Fe) tác dụng với axit clohidric (HCl) tạo ra muối sắt (II) clorua (FeCl2) và khí hiđro (H2.) a/ Viết PTHH. b/ Tính khối lượng của axit clohydric (HCl) cần dùng. c/ Tính thể tích khí H2.(đktc) thu được. Giúp tuii với
$a) Fe + 2HCl \to FeCl_2 + H_2$
$b) n_{Fe} = \dfrac{5,6}{56} = 0,1(mol)$
Theo PTHH : $n_{HCl} = 2n_{Fe} = 0,1.2 = 0,2(mol)$
$m_{HCl} = 0,2.36,5 = 7,3(gam)$
$c) n_{H_2} = n_{Fe} = 0,1(mol)$
$V_{H_2} = 0,1.22,4 = 2,24(lít)$
Đúng 3
Bình luận (0)
a: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
b: \(n_{Fe}=\dfrac{5.6}{56}=0.1\left(mol\right)=n_{FeCl_2}\)
\(\Leftrightarrow n_{HCl}=2\cdot0.1=0.2\left(mol\right)\)
\(m=0.2\cdot36.5=7.3\left(g\right)\)
c: \(V_{H_2}=0.1\cdot22.4=2.24\left(lít\right)\)
Đúng 1
Bình luận (0)
\(a. Fe+2HCl->FeCl_2+H_2\)
c, \(n_{Fe}=\dfrac{5,6}{56}=0,1\)
\(-> n_{H_2}=n_{FeCl_2}=0,1\)
\(-> V_{H_2}=0,1.22,4=2,24\)
Đúng 1
Bình luận (0)
. Cho 5,6 g sắt Fe tác dụng với dung dịch có chứa 7,3 g axit clohidric HCl tạo thành sắt (II) clorua FeCl2 và 0,2 g khí hidro. Tính khối lượng sắt (II) clorua tạo thành ?
Bảo toàn KL: \(m_{Fe}+m_{HCl}=m_{FeCl_2}+m_{H_2}\)
\(\Rightarrow m_{FeCl_2}=5,6+7,3-0,2=12,7(g)\)
Đúng 1
Bình luận (0)
Cho 5,6 g sắt Fe tác dụng với dung dịch có chứa 7,3 g axit clohidric HCl tạo thành sắt (II) clorua FeCl2 và 0,2 g khí hidro. Tính khối lượng sắt (II) clorua tạo thành ?
giải giúp em em cảm ơn nhiều
\(BTKL:n_{Fe}+n_{HCl}=n_{FeCl_2}+n_{H_2}\\ \Rightarrow n_{FeCl_2}=5,6+7,3-0,2=12,7(g)\)
Đúng 1
Bình luận (0)
Cho 5,6g sắt tác dụng hoàn toàn với axit clohidric (HCl) tạo thành sắt (II) clorua (FeCl2) và khí hidro (H2)
a) viết pthh
b)tính khối lượng axit tham gia phản ứng
giúp mình với
a: Fe+2HCl->FeCl2+H2
0,1 0,2 0,1
b: nFe=5,6/56=0,1(mol)
=>nHCl=0,2(mol)
mHCl=0,2*36,5=7,3(g)
Đúng 1
Bình luận (0)
Cho 112g sắt tác dụng với hoàn toàn dung dịch HCL tạo ra 254g sắt(II) clorua và 44,8l khí H2 . Tính Khối lượng axit HCL đã dùng
\(n_{H_2}=\dfrac{44,8}{22,4}=2\left(mol\right)\Rightarrow m_{H_2}=2.2=4\left(g\right)\)
Theo ĐLBTKL: mFe + mHCl = mFeCl2 + mH2
=> mHCl = 254 + 4 - 112 = 146 (g)
Đúng 2
Bình luận (0)
BTKLg:
mFe+m HCl=mFeCl2+m H2
=>m HCl=254+\(\dfrac{44,8}{22,4}2\)-112
=146g
Đúng 1
Bình luận (0)
Bài 1. Hòa tan hoàn toàn 11,2 gam sắt vào axit clohidric (HCl) thu được sắt (II) clorua (FeCl2) và khí hidro.
a. Viết phương trình há học xảy ra.
b. Tính thể tích khí hidro sinh ra ở đktc.
c. Tính khối lượng axit clohidric đã dùng.
a,\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: 0,2 0,4 0,2
b, \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
c, \(m_{HCl}=0,4.36,5=14,6\left(g\right)\)
Đúng 3
Bình luận (0)
Bài 1. Hòa tan hoàn toàn 11,2 gam sắt vào axit clohidric (HCl) thu được sắt (II) clorua (FeCl2) và khí hidro.
a. Viết phương trình há học xảy ra.
b. Tính thể tích khí hidro sinh ra ở đktc.
c. Tính khối lượng axit clohidric đã dùng.
\(n_{Fe}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(0.2.......0.4....................0.2\)
\(V_{H_2}=0.2\cdot22.4=4.48\left(l\right)\)
\(m_{HCl}=0.4\cdot36.5=14.6\left(g\right)\)
Đúng 3
Bình luận (0)
PTHH : \(Fe+2HCl-->FeCl_2+H_2\uparrow\) (1)
\(n_{Fe}=\dfrac{m}{M}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
Từ (1) => \(n_{Fe}=n_{H_2}=0.2\left(mol\right)\)
=> \(V_{H2\left(đktc\right)}=n.22,4=0,2.22,4=4,48\left(l\right)\)
Từ (1) => \(2n_{Fe}=n_{HCl}=0.4\left(mol\right)\)
=> \(m_{HCl}=n.M=0,4.\left(1+35.5\right)=14.6\left(g\right)\)
Đúng 3
Bình luận (0)