cau10 Trong phòng thí nghiệm, người ta dùng hiđro để khử sắt (III) oxit và thu được 11,2g sắt. Tinh khối lượng sắt (III) oxit đã phản ứng?

Những câu hỏi liên quan
bài 10 trong phòng thí nghiệm người ta dùng hidro để khử sắt (III) oxit và thu được 11,2g sắt . Tính khối lượng sắt (III)oxit đã phản ứng
\(n_{Fe}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
\(Fe_2O_3+3H_2\underrightarrow{^{^{t^0}}}2Fe+3H_2O\)
\(0.1.....................0.2\)
\(m_{Fe_2O_3}=0.1\cdot160=16\left(g\right)\)
Đúng 1
Bình luận (0)
Trong phòng thí nghiệm, người ta dùng hiđro để khử sắt(III) oxit và thu được 11,2 gam sắt.
Viết phản ứng hóa học xảy ra.
Tính khối lượng sắt(III) oxit đã phản ứng.
Tính thể tích khí hiđro đã tiêu thụ (đktc).
Trong phòng thí nghiệm người ta dùng hiđro để khử sắt (III) oxi và thu được 12,6 g sắt.
a. Tính khối lượng sắt (III) oxit đã phản ứng;
b. Tính thể tích khí hiđro đã tiêu thụ (ở đktc).
Fe2O3+3H2-to>2Fe+3H2O
0,1125---0,3375----0,225 mol
n Fe=0,225 mol
=>m Fe2O3=0,1125.160=18g
=>VH2=0,3375.22,4=7,56l
Đúng 3
Bình luận (0)
a,\(n_{Fe}=\dfrac{12,6}{56}=0,225\left(mol\right)\)
PTHH: 3H2 + Fe2O3 ---to---> 2Fe + 3H2O
Mol: 0,3375 0,1125
\(m_{Fe_2O_3}=0,1125.160=18\left(g\right)\)
b, \(V0,3375.22,4=7,56\left(l\right)\)
Đúng 1
Bình luận (0)
Xem thêm câu trả lời
:Trong phòng thí nghiệm người ta dùng khí hiđro để khử sắt(III) oxit và thu được 11,2 gam Fe. a) Viết phương trình hóa học của phản ứng đã xảy ra.
b) Tính khối lượng sắt(III) oxit đã phản ứng.
c) Tính thể tích khí hiđro đã tiêu thụ (ở đktc).
a, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Theo PT: \(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,1\left(mol\right)\Rightarrow m_{Fe_2O_3}=0,1.160=16\left(g\right)\)
c, Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Fe}=0,3\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,3.22,4=6,72\left(l\right)\)
Đúng 1
Bình luận (0)
Trong phòng thí nghiệm ,người ta dùng hiđro để khử sắt(III)oxit(Fe2O3) thu được 24 gam sắt. a. Viết phương trình hóa học của phản ứng xảy ra b.tính số gam sắt(III)oxit đã phản ứng c. tính thể tích khí hiđro dùng để khử(ở đktc)
a, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Fe}=\dfrac{24}{56}=\dfrac{3}{7}\left(mol\right)\)
Theo PT: \(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=\dfrac{3}{14}\left(mol\right)\Rightarrow m_{Fe_2O_3}=\dfrac{3}{14}.160=\dfrac{240}{7}\left(g\right)\)
c, Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Fe}=\dfrac{9}{14}\left(mol\right)\Rightarrow V_{H_2}=\dfrac{9}{14}.22,4=14,4\left(l\right)\)
Đúng 2
Bình luận (0)
\(n_{Fe}=\dfrac{m}{M}=\dfrac{24}{56}\approx0,43\left(mol\right)\\ a.PTHH:Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
2 3 2 3
0,43 0,645 0,45 0,645
\(b.m_{Fe_2O_3}=n.M=0,43.\left(56.2+16.3\right)=68,8\left(g\right)\\ c.V_{H_2}=n.24,79=0,645.24,79=15,98955\left(l\right).\)
Đúng 1
Bình luận (0)
a)\(PTHH:Fe_3O_4+4H_2\xrightarrow[]{}3Fe+4H_2O\)
b)\(m_{Fe}=\dfrac{24}{56}=0,4\left(m\right)\)
\(PTHH:Fe_3O_4+4H_2\xrightarrow[]{}3Fe+4H_2O\)
tỉ lệ :1 4 3 4
số mol :0,13 0,53 0,4 0,53
\(m_{Fe_3O_4}=0,13.232=30,16\left(g\right)\)
c)\(V_{H_2}=0,53.22,4=11,872\left(l\right)\)
Đúng 1
Bình luận (2)
Bài 2 : Trong phòng thí nghiệm, người ta dùng 6,72 lít khí hidro để khử sắt (III) oxit và thu được sắt và hơi nước .a) Viết phương trình hóa học của phản ứng đã xảy ra.b) Tính khối lượng sắt (III) oxit đã phản ứng.c) Tính khối lượng sắt tạo thành. Bài 3 : Trong phòng thí nghiệm, người ta điều chế 11,6g oxit sắt từ bằng cách oxi hóa sắt ở nhiệt độ cao.a) Viết phương trình hóa học xảy ra .b) Tính số gam sắt cần dùng .c) Tính thể tích khí oxi ở đktcd) Tính số gam Kali c...
Đọc tiếp
Bài 2 : Trong phòng thí nghiệm, người ta dùng 6,72 lít khí hidro để khử sắt (III) oxit và thu được sắt và hơi nước .
a) Viết phương trình hóa học của phản ứng đã xảy ra.
b) Tính khối lượng sắt (III) oxit đã phản ứng.
c) Tính khối lượng sắt tạo thành.
Bài 3 : Trong phòng thí nghiệm, người ta điều chế 11,6g oxit sắt từ bằng cách oxi hóa sắt ở nhiệt độ cao.
a) Viết phương trình hóa học xảy ra .
b) Tính số gam sắt cần dùng .
c) Tính thể tích khí oxi ở đktc
d) Tính số gam Kali clorat cần dùng để điều chế được lượng oxi đã tham gia phản ứng trên.
Fe = 56 , O =16 , K= 39 , Cl =35,5
2)
nH2 = 6.72/22.4 = 0.3 (mol)
Fe2O3 + 3H2 -to-> 2Fe + 3H2O
0.1______0.3______0.2
mFe2O3 = 0.1*160 = 16 (g)
mFe = 0.2*56 = 11.2 (g)
3)
nFe3O4 = 11.6/232 = 0.05 (mol)
3Fe + 2O2 -to-> Fe3O4
0.15___0.1______0.05
mFe = 0.15*56 = 8.4 (g)
VO2 = 0.1*22.4 = 2.24 (l)
2KClO3 -to-> 2KCl + 3O2
1/15______________0.1
mKClO3 = 1/15 * 122.5 = 8.167 (g)
Đúng 1
Bình luận (0)
a)
3H2 + Fe2O3 --to--> 2Fe + 3H2O
b) nH2 = 6,72/22,4 = 0,3 mol
Từ pt => nFe3O4 = 0,1 mol
=> mFe3O4 = 0,1. 232 = 23,2 g
Đúng 0
Bình luận (0)
1.
a) 3H2 + Fe2O3 --to--> 2Fe + 3H2O
b) nH2 = 6,72/22,4 = 0,3 mol
Từ pt => nFe3O4 = 0,1 mol
=> mFe3O4 = 0,1. 232 = 23,2 g
c) nFe = 0,2 mol
=> mFe = 0,2 . 56 = 11,2 (g)
Đúng 0
Bình luận (0)
Trong phòng thí nghiệm người ta dùng khí hiđro để khử sắt(II) oxit và thu được 11,2 g Fe.
a) Viết phương trình hóa học của phản ứng đã xảy ra.
b) Tính khối lượng sắt (III) oxit đã phản ứng.
c) Tính thể tích khí hiđro đã tiêu thụ (đktc).
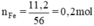
Phương trình hóa học của phản ứng:
Fe2O3 + 3H2 → 2Fe + 3H2O.
Khử 1 mol Fe2O3 cho 2 mol Fe.
x mol Fe2O3 → 0,2 mol.
x = 0,2 : 2 =0,1 mol.
m = 0,1 .160 =16g.
Khử 1 mol Fe2O3 cần 3 mol H2.
Vậy khử 0,1 mol Fe2O3 cần 0,3 mol H2.
V= 0,3 .22.4 = 6,72l.
Đúng 0
Bình luận (0)
Trong phòng thí nghiệm, người ta dùng khí hiđro để khử sắt (III) oxit Fe2O3 và thu được 11,2 gam sắt. Tính khối lượng Fe2O3 đã bị khử
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(PTHH:Fe_2O_3+3H_2\xrightarrow[]{}2Fe+3H_2O\)
tỉ lệ :1 3 2 3
số mol :0,1 0,3 0,2 0,3
\(m_{Fe_2O_3}=0,1.160=16\left(g\right)\)
Đúng 2
Bình luận (0)
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(Fe_2O_3+3H_2\xrightarrow[]{t^\circ}2Fe+3H_2O\uparrow\)
0,1 ← 0,2
\(\Rightarrow m_{Fe_2O_3}=0,1\cdot160=16\left(g\right)\)
Đúng 2
Bình luận (0)
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Theo PT: \(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,1\left(mol\right)\Rightarrow m_{Fe_2O_3}=0,1.160=16\left(g\right)\)
Đúng 1
Bình luận (0)
Trong phòng thí nghiệm, người ta dùng hidro để khử sắt (III) oxit và thu được 11,2 gam sắt.
Viết phương trình hoá học của phản ứng đã xảy ra.
Tính khối lượng sắt(III) oxit đã phản ứng.
Tính thể tích khí hidro đã tiêu thụ (ở đktc).

























