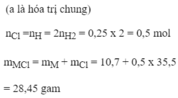phân hiuyr hoàn toàn 61,25 gam KCIO3 thu được bao nhiêu lít khí oxi ở(đktc)biết(K=39,Cl=35,5;O=16)

Những câu hỏi liên quan
Nhiệt phân hoàn toàn 12,25g KCIO3 thu được bao nhiêu lít khí oxi(ở dktc)?
(Biết K=39;O=16;Cl=35,5)
\(n_{KClO_3}=\dfrac{12,25}{122,5}=0,1mol\)
\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
0,1 0,15 ( mol )
\(V_{O_2}=0,15.22,4=3,36l\)
Đúng 4
Bình luận (1)
nKClO3 = 12,25 : 122,5 = 0,1 (mol)
pthh : 2KClO3 -t--> 2KCl + 3O2
0,1 --------------------->0,15 (mol)
=> VO2(dktc) = 0,15 . 22,4 = 3,36 ( l)
Đúng 1
Bình luận (1)
tính khối lượng KCLO3 đã bị nhiệt phân, biết rằng thể tích khí oxi thu được sau phản ứng là 6,72 lít (ở đktc) (biết K:39; Cl:35,5; O:16
nO2=6,72/22,4=0,3 mol
PTPƯ: 2KClO3 Nhiệt Phân→ 2KCl + 3O2↑
0,3 mol O2 ---> 0,2 mol KClO3
nên mKClO3=122,5.0,2=24,5 g
Đúng 1
Bình luận (0)
Một hỗn hợp foomf Fe, Mg, Al có khối lượng 10,7 gam cho tan hoàn toàn trong dung dịch HCl thì thu được 5,6 lít khí (ở đktc). Khi chưng khô dung dịch thu được bao nhiêu gam muối (Cl=35,5)?
Khi phân huỷ 122,5g KClO3 có xúc tác ở nhiệt độ cao, thể tích khí oxi thu được ở đktc là (K = 39, Cl = 35,5 ; O = 16) A. 33,6 lít B. 3,36 lít C. 11,2 lít D. 1,12 lít
\(pthh:2KClO_3\xrightarrow[MnO_2]{t^o}2KCl+3O_2\uparrow\)
\(n_{KClO_3}=\dfrac{122,5}{122,5}=1\left(mol\right)\)
Theo pt: \(n_{O_2}=\dfrac{3}{2}.1=1,5\left(mol\right)\)
\(\Rightarrow V_{O_2}=1,5.22,4=33,6\left(lít\right)\)
Chọn A
Đúng 2
Bình luận (1)
nKClO3 = 122,5/122,5 = 1 (mol)
PTHH: 2KClO3 -> (t°, MnO2) 2KCl + 3O2
nO2 = 1 : 2 . 3 = 1,5 (mol)
VO2 = 1,5 . 22,4 = 33,6(l)
Đúng 0
Bình luận (0)
Nhiệt phân hoàn toàn 49 gam KClO3 thì thu được bao nhiêu gam KCl và bao nhiêu lít khí oxi ở đktc?
Ta có: \(n_{KClO_3}=\dfrac{49}{122,5}=0,4\left(mol\right)\)
PT: \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
______0,4______0,4_____0,6 (mol)
\(\Rightarrow m_{KCl}=0,4.74,5=29,8\left(g\right)\)
\(V_{O_2}=0,6.22,4=13,44\left(l\right)\)
Đúng 2
Bình luận (0)
nhiệt phân hoàn toàn m gam kali clorat KCIO3 thu được kali clorua KCI và khí oxi . Xác định giá trị của m khi có 6,72 lít O2 thoát ra (đktc)
\(PTHH:2KClO_3\underrightarrow{t^o}2KCl+3O_2\\ n_{O_2}=\dfrac{V_{\left(đktc\right)}}{22,4}=\dfrac{67,2}{22,4}=3\left(mol\right)\\ Theo.PTHH:n_{KClO_3}=\dfrac{2}{3}.n_{O_2}=\dfrac{2}{3}.3=2\left(mol\right)\\ m_{KClO_3}=n.M=2.122,5=245\left(g\right)\)
Đúng 1
Bình luận (0)
a) Nhiệt phân m gam KMnO4 thu được 11,2 lít khí oxi (đktc). Tính m. (K 39; Mn 55; O 16)b) Khử hoàn toàn 80 gam Fe2O3 bằng V lít (đktc) khí hiđro ở nhiệt độ cao. Tính V. ( Fe 56; O 16)c) Cho 8 gam bột CuO tác dụng với 1,12 lít khí H2 (đktc) ở nhiệt độ cao. (O 16; Cu 64)- Chất nào còn dư sau phản ứng và dư là bao nhiêu mol?- Tính khối lượng chất rắn và thể tích chất khí (đktc) thu được sau phản ứng.
Đọc tiếp
a) Nhiệt phân m gam KMnO4 thu được 11,2 lít khí oxi (đktc). Tính m. (K = 39; Mn = 55; O = 16)
b) Khử hoàn toàn 80 gam Fe2O3 bằng V lít (đktc) khí hiđro ở nhiệt độ cao. Tính V. ( Fe = 56; O = 16)
c) Cho 8 gam bột CuO tác dụng với 1,12 lít khí H2 (đktc) ở nhiệt độ cao. (O = 16; Cu = 64)
- Chất nào còn dư sau phản ứng và dư là bao nhiêu mol?
- Tính khối lượng chất rắn và thể tích chất khí (đktc) thu được sau phản ứng.
a) \(n_{O_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
1<-----------------------------0,5
=> \(m_{KMnO_4}=1.158=158\left(g\right)\)
b) \(n_{Fe_2O_3}=\dfrac{80}{160}=0,5\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,5--->1,5
=> \(V_{H_2}=1,5.22,4=33,6\left(l\right)\)
c) \(n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\)
\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,05}{1}\) => CuO dư, H2 hết
PTHH: CuO + H2 --to--> Cu + H2O
0,05<-0,05---->0,05-->0,05
=> \(n_{Cu\left(dư\right)}=0,1-0,05=0,05\left(mol\right)\)
mCu = 0,05.64 = 3,2 (g)
VH2O = 0,05.22,4 = 1,12 (l)
Đúng 2
Bình luận (0)
a)\(n_{O_2}=\dfrac{11,2}{22,4}=0,5mol\)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
1 0,5
\(M_{KMnO_4}=1\cdot158=158g\)
b)\(n_{Fe_2O_3}=\dfrac{80}{160}=0,5mol\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
0,5 1,5
\(V_{H_2}=1,15\cdot22,4=25,76l\)
Đúng 0
Bình luận (0)
Câu: biết rằng Oxi chiếm 20% thể tích không khí. Đốt cháy hoàn toàn 6,4 gam Cu bằng khí oxi
a) tính thể tích không khí cần dùng (đktc)
b) tính số gam KClO3 cần dùng để điều chế lượng oxi trên ( Cho Cu=64, K=39, Cl=35,5. O=16)
a.\(n_{Cu}=\dfrac{6,4}{64}=0,1mol\)
\(2Cu+O_2\rightarrow\left(t^o\right)2CuO\)
0,1 0,05 ( mol )
\(V_{kk}=\left(0,05.22,4\right).5=5,6l\)
b.\(2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\)
1/30 0,05 ( mol )
\(m_{KClO_3}=\dfrac{1}{30}.122,5=4,08g\)
Đúng 2
Bình luận (0)
Câu 3: K = 39; Cl = 35,5; O = 16. Trong phòng thí nghiệm để điều chế được 6,72 lít oxi (đktc) thì cần bao nhiêu gam Kali clorat (KClO3): *
nO2=6,72/22,4=0,3(mol)
PTHH: 2 KClO3 -to->2 KCl +3 O2
Ta có: nKClO3=2/3. 0,3=0,2(mol)
=>mKClO3=0,2.122,5=24,5(g)
Đúng 4
Bình luận (0)