Những nguyên tử nào dưới đây thuộc cùng một nguyên tố hóa học?
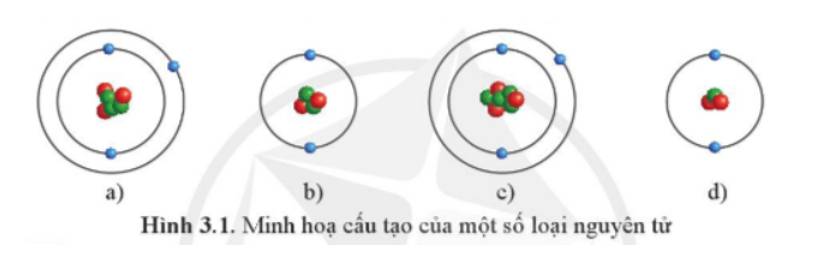
Những nguyên tử nào dưới đây thuộc cùng một nguyên tố hóa học?

Nguyên tử lithium (Li) có 3 proton trong hạt nhân. Khi Li tác dụng với khí chlorine (Cl2) sẽ thu được muối lithium chloride (LiCl), trong đó, Li tồn tại ở dạng ion Li+. Ion Li+ có bao nhiêu proton trong hạt nhân?
Thảo luận (1)Hướng dẫn giải- Nguyên tử Li và ion Li+ đều thuộc cùng 1 nguyên tố hóa học là Li
- Li+ là nguyên tử Li sau khi mất đi 1 electron. Do vậy Li+ sẽ có 3 proton và 2 electron
=> Trong hạt nhân Li và Li+ đều có cùng số hạt proton là 3.
(Trả lời bởi Hà Quang Minh)
Phân tử S8 có 128 electron, hỏi số hiệu nguyên tử của lưu huỳnh (S) là bao nhiêu?
Thảo luận (1)Hướng dẫn giải- Phân tử S8 nghĩa là có 8 nguyên tử S
=> 1 nguyên tử S có 128 : 8 = 16 electron
- Nguyên tử trung hòa về điện có số hạt proton = số hạt electron
=> Nguyên tử S có 16 proton
- Mà số proton trong một hạt nhân nguyên tử được gọi là số hiệu nguyên tử
=> Nguyên tử S có số hiệu nguyên tử là 16
(Trả lời bởi Hà Quang Minh)
Một nguyên tử có Z hạt proton, Z hạt electron và N hạt neutron. Tính khối lượng (gần đúng theo amu) và số khối của nguyên tử này. Nhận xét về kết quả thu được.
Thảo luận (1)Hướng dẫn giảiTa có:
+ Khối lượng nguyên tử = số proton + số neutron + số electron. 0,00055 = Z + N + 0,00055.Z ≈ Z + N
+ Số khối nguyên tử = số proton + số neutron = Z + N
Như vật khối lượng (gần đúng, theo amu) và số khối của nguyên tử có thể coi là bằng nhau.
(Trả lời bởi Hà Quang Minh)
Một loại nguyên tử lithium có 3 proton và 4 neutron. Viết kí hiệu nguyên tử của lithium đó.
Thảo luận (1)Hướng dẫn giải- Nguyên tử C có 6 proton, 6 neutron
=> Số hiệu nguyên tử Z = 6, số khối A = số proton + số neutron = 6 + 6 = 12
- Kí hiệu nguyên tử: \({}_{11}^{23}X\)
=> Số proton = Z = 11, số neutron = A – số proton = 23 – 11 = 12
(Trả lời bởi Hà Quang Minh)
Hoàn thành bảng sau:

Thảo luận (1)Hướng dẫn giải(Trả lời bởi Hà Quang Minh)
Nguyên tử
Số p
Số n
Kí hiệu nguyên tử
C
6
6
\({}_6^{12}C\)
X
11
12
\({}_{11}^{23}X\)
Cho các nguyên tử sau:
\({}_2^5X\), \({}_3^7Y\), \({}_4^9Z\), \({}_5^{11}M\), \({}_5^{12}T\)
Những nguyên tử nào là đồng vị của nhau?
Thảo luận (1)Hướng dẫn giải- Trong các nguyên tử: \({}_2^5X\), \({}_3^7Y\), \({}_4^9Z\), \({}_5^{11}M\), \({}_5^{12}T\). Chỉ có nguyên tử M và T là có số hiệu nguyên tử (số proton) bằng nhau.
=> Nguyên tử M và T là đồng vị của nhau.
(Trả lời bởi Hà Quang Minh)
Nguyên tố oxygen có 17 đồng vị, bắt đầu từ \({}_8^{12}O\), kết thúc là \({}_8^{28}O\). Các đồng vị oxygen có tỉ lệ giữa số hạt neutron (N) và số hiệu nguyên tử thỏa mãn \(1 \leqslant \frac{N}{Z} \leqslant 1,25\)thì bền vững. Hỏi trong tự nhiên thường gặp đồng vị nào của oxygen?
Thảo luận (1)Hướng dẫn giảiTa có: Nguyên tử oxygen có số hiệu nguyên tử Z = 8
Mà số hiệu nguyên tử thỏa mãn \(1 \leqslant \frac{N}{Z} \leqslant 1,25\) thì bền vững
Thay Z vào bất phương trình \(1 \leqslant \frac{N}{Z} \leqslant 1,25\) ta được:
\(1 \leqslant \frac{N}{8} \leqslant 1,25\)
=> \(8 \leqslant N \leqslant 10\)
=> \(8 + Z \leqslant N + Z \leqslant 10 + Z\)
=> \(16 \leqslant A \leqslant 18\)
Vậy các đồng vị thường gặp của oxygen là: \({}_8^{16}O\), \({}_8^{17}O\), \({}_8^{18}O\).
(Trả lời bởi Hà Quang Minh)
Em hãy tìm hiểu đồng vị nào của oxygen chiếm tỉ lệ lớn nhất trong tự nhiên.
Thảo luận (1)Hướng dẫn giảiTrong tự nhiên:
+ Đồng vị \({}_8^{16}O\) chiếm 99,757%
+ Đồng vị \({}_8^{17}O\) chiếm 0,039%
+ Đồng vị \({}_8^{18}O\) chiếm 0,204%
=> Đồng vị \({}_8^{16}O\) của oxygen chiếm tỉ lệ lớn nhất trong tự nhiên
(Trả lời bởi Hà Quang Minh)
Trong tự nhiên, argon có các đồng vị \({}^{40}{\text{Ar}}\),\(^{38}{\text{Ar}}\), \({}^{36}{\text{Ar}}\)chiếm tương ứng khoảng 99,604%; 0,063% và 0,333% số nguyên tử. Tính nguyên tử khối trung bình của Ar.
Thảo luận (1)Hướng dẫn giảiTa có: \({}^{40}{\text{Ar}}\) chiếm 99,604%; \(^{38}{\text{Ar}}\) chiếm 0,063%; \({}^{36}{\text{Ar}}\)chiếm 0,333%
=> \({M_{{\text{Ar}}}} = \frac{{99,694.40 + 0,063.38 + 0,333.36}}{{100}} = 40,02\)
Vậy nguyên tử khối trung bình của Ar là 40,02.
(Trả lời bởi Hà Quang Minh)