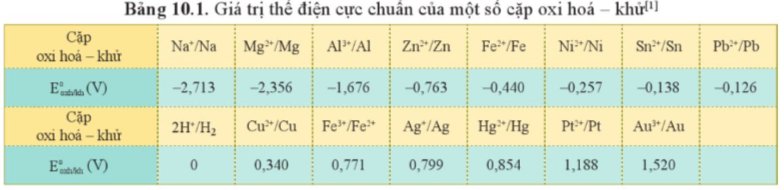
Từ giá trị thế điện cực chuẩn của các cặp oxi hóa – khử ở Bảng 10.1 và giá trị \(E_{2H_2O\text{/}OH^-+H_2}\) = - 0,413 V ở môi trường trung tính, cho biết phản ứng nào sau đây có thể xảy ra. Viết phương trình hóa học của phản ứng (nếu có).
a) Ag(s) + Cu2+(aq) →
b) Sn(s) + Cu2+(aq) →
c) Ni(s) + H2O(l) →
Có:
$E^o{ }_{A g^{+} / A g}=0,799 \mathrm{~V}>E^o{ }_{C u^{2+}} / C u=0,34 \mathrm{~V}$ nên phản ứng a không xảy ra.
$E^o{ }_{S n^{2+}} / S n=-0,138 \vee<E^o{ }_{C u^{2+}} / C u^{=}=0,34 \mathrm{~V}$ nên phản ứng b xảy ra.
$\mathrm{Sn}_{(s)}+\mathrm{Cu}^{2+}{ }_{(a q)} \rightarrow \mathrm{Sn}^{2+}{ }_{(a q)}+\mathrm{Cu}_{(s)}$
$E^o{ }_{N i^{2+}} / N i=-0,257 \mathrm{~V}>E_{2 \mathrm{H}_2 \mathrm{O} / 2 O H^{-}+\mathrm{H}_2}=-0,413 \mathrm{~V}$ nên phản ứng c không xảy ra.


