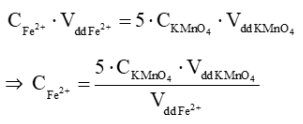Thí nghiệm: Xác định nồng độ của dung dịch FeSO4 bằng dung dịch KMnO4 (dung dịch thuốc tím)
Chuẩn bị:
- Hóa chất: Dung dịch thuốc tím KMnO4 có nồng độ chính xác 0,02M, dung dịch FeSO4 có nồng độ khoảng 0,1M; dung dịch H2SO4 20%
- Dụng cụ: Burette loại 25ml, bình tam giác loại 100ml
Tiến hành:
- Lắp bộ dụng cụ như Hình 20.1. Cho dung dịch thuốc tím vào burette đến vạch 0 đồng thời bảo đảm không còn bọt khí trong burette. Cho 10ml dung dịch FeSO4 và 5ml dung dịch H2SO4 20% vào bình tam giác.
- Mở khóa để nhỏ từ từ từng giọt dung dịch thuốc tím vào bình tam giác, đồng thời lắc đều bình
- Tiếp tục nhỏ dung dịch thuốc tím (vẫn duy trì lắc đều bình) tới khi dung dịch trong bình tam giác xuất hiện màu hồng nhạt bởi một giọt thuốc tím dư, không mất màu trong khoảng 20 giây thì kết thúc chuẩn độ (khóa burette).
- Ghi lại thể tích dung dịch thuốc tím đã dùng. Lặp lại thí nghiệm ít nhất hai lần nữa.
Yêu cầu: Xác định nồng độ của dung dịch FeSO4. Biết phương trình hóa học của phản ứng diễn ra trong quá trình chuẩn độ là:
5Fe2+(aq) + MnO4-(aq) + 8H+(aq) → 5Fe3+(aq) + Mn2+(aq) + 4H2O(l)
Gọi thể tích dung dịch KMnO4 đã dùng ở các lần đo lần lượt là V1, V2, …, Vn
Ta có thể tích trung bình của dung dịch KMnO4 là:
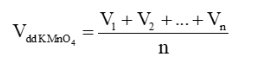
Theo phương trình chuẩn độ, ta có:
⇒