Bài 35: Benzen và đồng đẳng. Một số hiđrocacbon thơm khác
Nội dung lý thuyết
Hidrocacbon thơm là những hidrocacbon trong phân tử có chứa một hay nhiều vòng benzen.

A. BENZEN VÀ ĐỒNG ĐẲNG
I. ĐỒNG ĐẲNG, ĐỒNG PHÂN, DANH PHÁP, CẤU TẠO
1. Dãy đồng đẳng của benzen
Benzen C6H6 và các hidrocacbon thơm khác có công thức phân tử là C7H8 và C8H10... lập thành dãy đồng đẳng có công thức phân tử chung là CnH2n-6 (n≥6).
2. Đồng phân, danh pháp
a) Đồng phân
Hai chất đầu dãy đồng đẳng của benzen là C6H6 và C7H8 không có đồng phân.
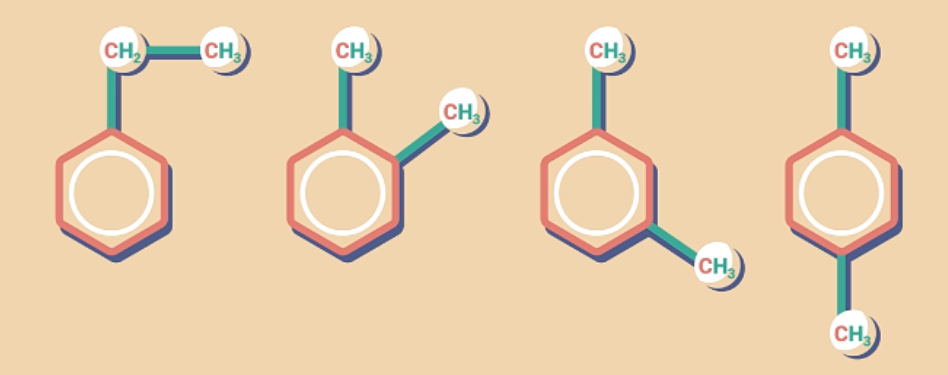
Từ C8H10 trở có đồng phân vị trí tương đối của các nhóm ankyl và đồng phân cấu tạo mạch cacbon của nhánh.
Ví dụ: C8H10 có các đồng phân sau:
b) Danh pháp
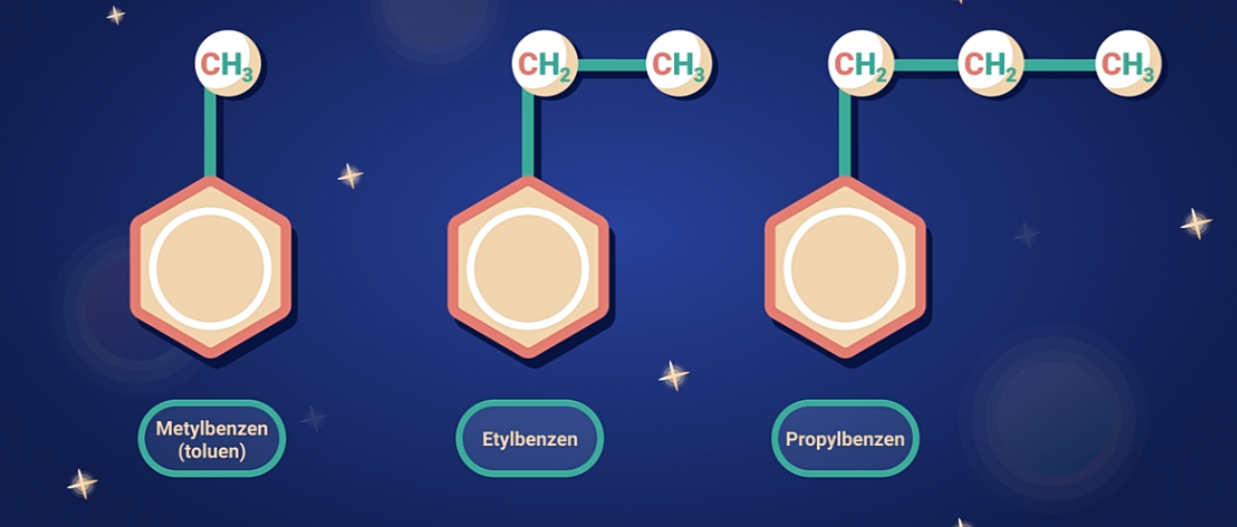
Để gọi tên benzen và đồng đẳng theo danh pháp hệ thống, ta gọi tên các nhóm ankyl liên kết trực tiếp với vòng benzen rồi sau đó + "benzen".
Ví dụ:
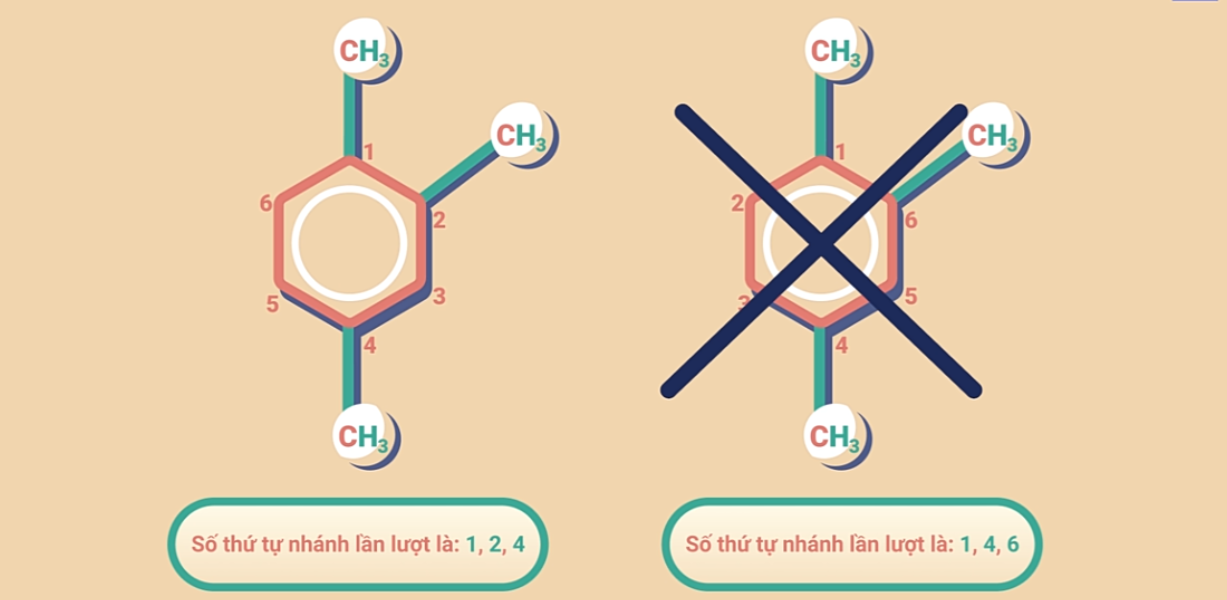
Nếu vòng benzen liên kết với hai hay nhiều nhóm ankyl thì trong tên gọi cần chỉ rõ vị trí của các nhóm ankyl trong vòng benzen. Ta đánh số các nguyên tử cacbon của vòng benzen sao cho tổng số chỉ vị trí các nhánh là nhỏ nhất. Các nhóm thế được gọi theo thứ tự chữ cái đầu tên gốc ankyl.
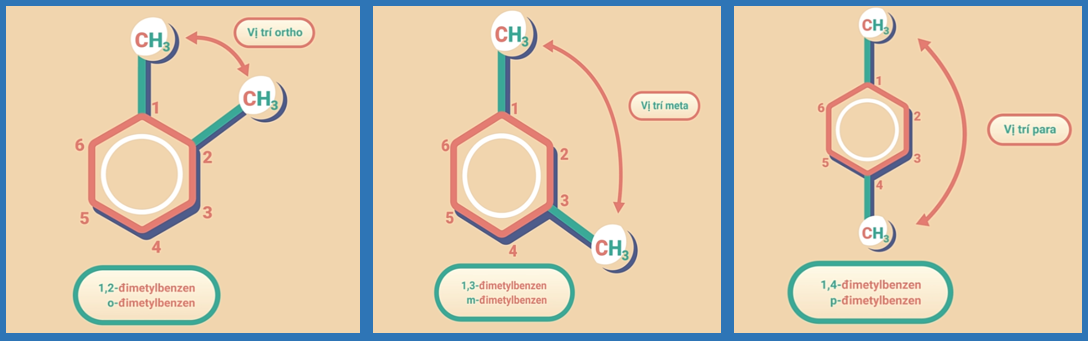
Ngoài ra, ta còn có thể sử dụng các chữ cái o-, m-, p-, để chỉ vị trí cho các mạch nhánh.
o-, m-, p- là viết tắt của các từ ortho-, meta- và para- sử dụng lần lần lượt cho các trường hợp 2 nhánh nằm ở vị trí 1,2; 1,3; và 1,4 với nhau.
3. Cấu tạo
Bằng các phương pháp phân tích hiện đại, người ta đã xác định được phân tử benzen có cấu trúc phẳng hình lục giác đều. Các 6 nguyên tử C và H đều nằm trên cùng một mặt phẳng.
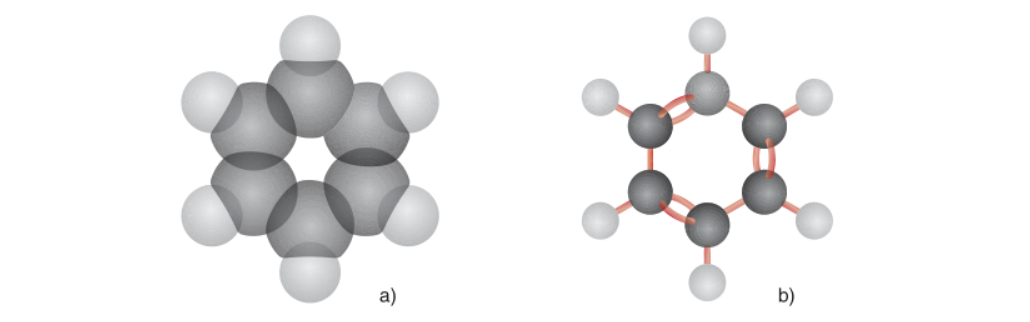
Mô hình phân tử của benzen dạng đặc (a) và dạng rỗng (b)
II. TÍNH CHẤT VẬT LÝ
- Các hidrocacbon thơm đều là chất lỏng hoặc rắn ở điều kiện thường, nhiệt độ sôi tăng dần theo chiều tăng của phân tử khối.
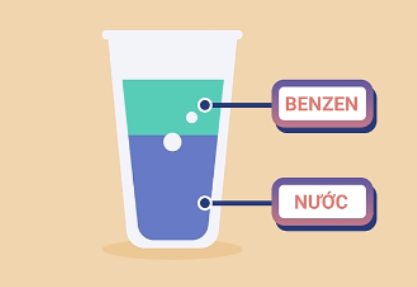
- Các hidrocacbon thơm ở thể lỏng có mùi đặc trưng, không tan trong nước và nhẹ hơn nước, có khả năng hòa tan nhiều chất hữu cơ.
III. TÍNH CHẤT HÓA HỌC
1. Phản ứng thế
a) Thế nguyên tử H của vòng benzen
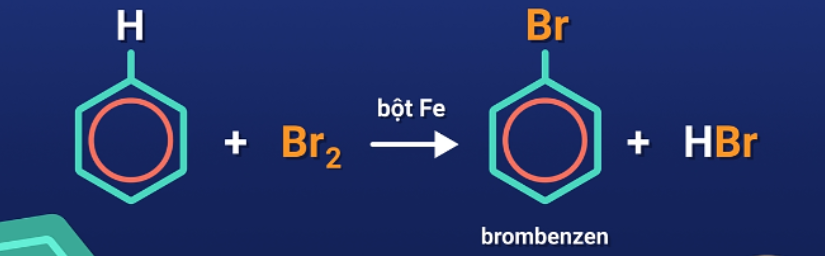
Phản ứng với halogen (brom)
Benzen và đồng đẳng không tham gia thế H của vòng benzen với dung dịch brom. Phản ứng chỉ xảy ra khi sử dụng brom nguyên chất và xúc tác là bột sắt.
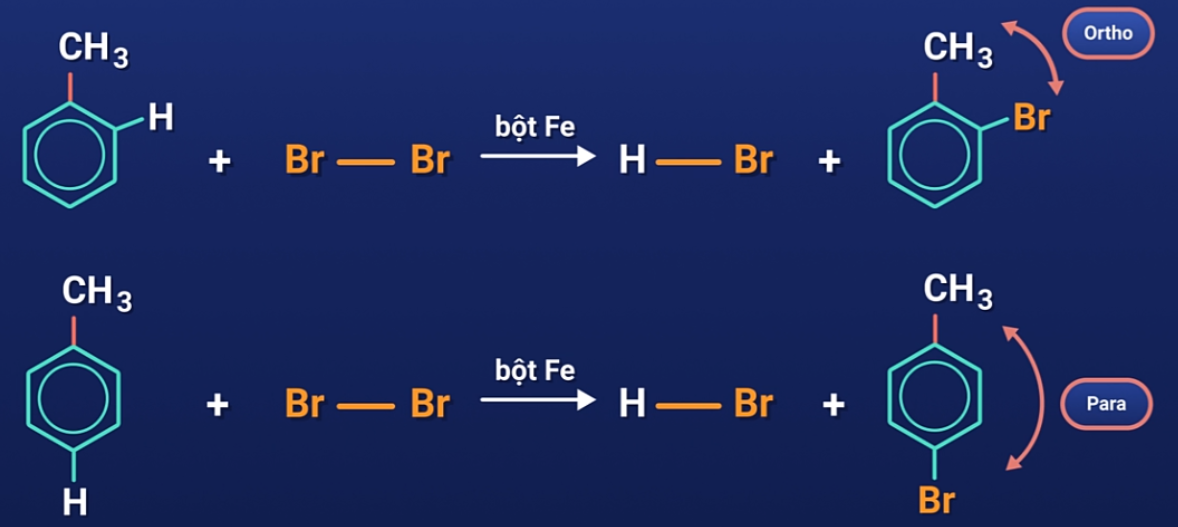
Đối với các ankylbenzen, sản phẩm thế brom thu được chủ yếu ở vị trí para và ortho so với nhóm ankyl.
Phản ứng với axit nitric
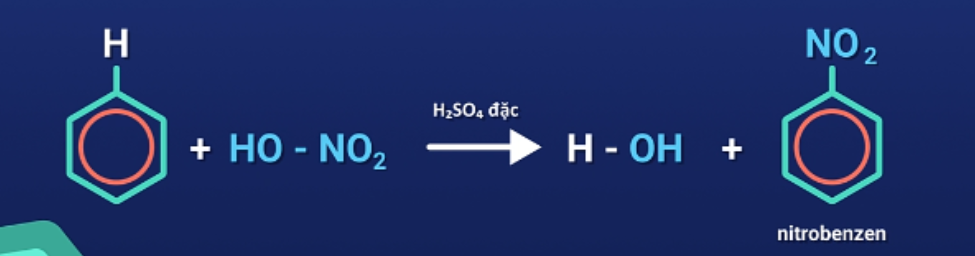
Trong điều kiện trên, các ankylbenzen cũng cho sản phẩm thế với axit nitric chủ yếu ở vị trị ortho và para so với nhóm ankyl.
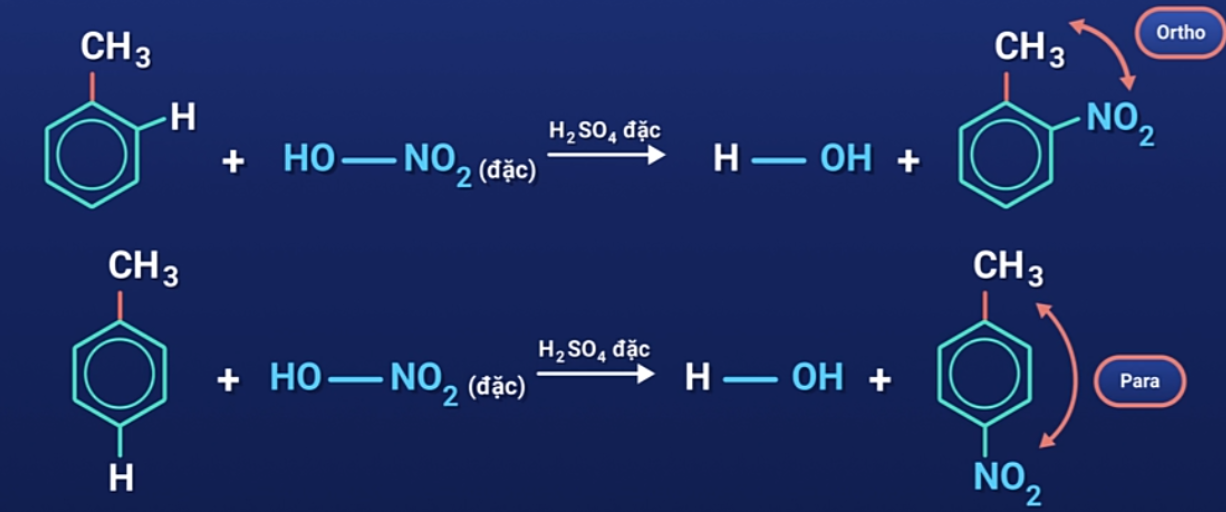
Quy tắc thế: Các ankylbenzen dễ tham gia phản ứng thế nguyên tử H của vòng benzen hơn benzen và sự thế ưu tiên ở vị trí ortho và para so với nhóm ankyl.
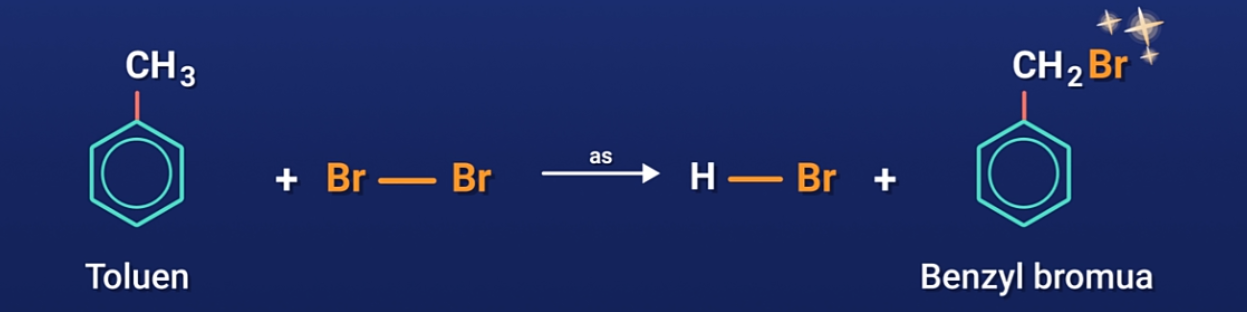
b) Thế nguyên tử H của mạch nhánh
Nếu không sử dụng bột Fe làm chất xúc tác mà đun nóng toluen hoặc các ankylbenzen với brom, sẽ xảy ra phản ứng thế nguyên tử H của mạch nhánh tương tự ankan.
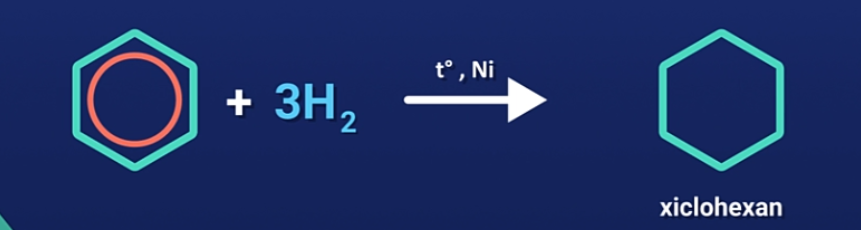
2. Phản ứng cộng hidro
a) Cộng hidro
b) Cộng clo
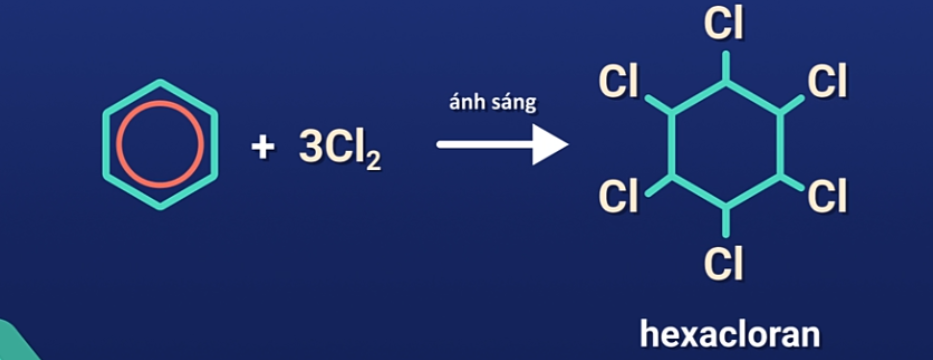
Trước kia, phản ứng này được dùng để điều chế thuốc trừ sâu 666 nhưng do hợp chất này có tính độc cao và phân hủy chậm gây ảnh hưởng xấu tới môi trường và sức khỏe con người nên ngày nên đã bị cấm sử dụng.
3. Phản ứng oxi hóa
- Phản ứng oxi hóa không hoàn toàn
| Benzen | Ankylbenzen | |
| Ở nhiệt độ thường | Không làm mất màu dung dịch | Không làm mất màu dung dịch |
| Khi đun nóng | Không làm mất màu dung dịch | Làm mất màu dung dịch KMnO4, tạo kết tủa đen MnO2↓ |
|
|
- Phản ứng oxi hóa hoàn toàn
Các hidrocacbon thơm khi cháy tỏa nhiều nhiệt.
CnH2n-6 + \(\dfrac{3n-3}{2}\)O2 nCO2 + (n-3)H2O
B. MỘT VÀI HIDROCACBON THƠM KHÁC
STIREN
1. Cấu tạo và tính chất vật lý
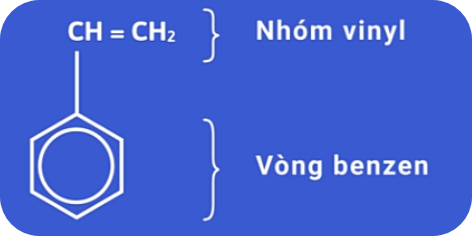
Công thức phân tử: C8H8
Phân tử stiren có cấu tạo phẳng và có công thức cấu tạo:
Stiren hay còn gọi là vinylbenzen là chất lỏng không màu, sôi ở 146oC, không tan trong nước nhưng tan nhiều trong các dung môi hữu cơ.
2. Tính chất hóa học
Stiren có cấu tạo giống với etilen và benzen, do đó stiren vừa có tính chất giống anken vừa có tính chất giống benzen.
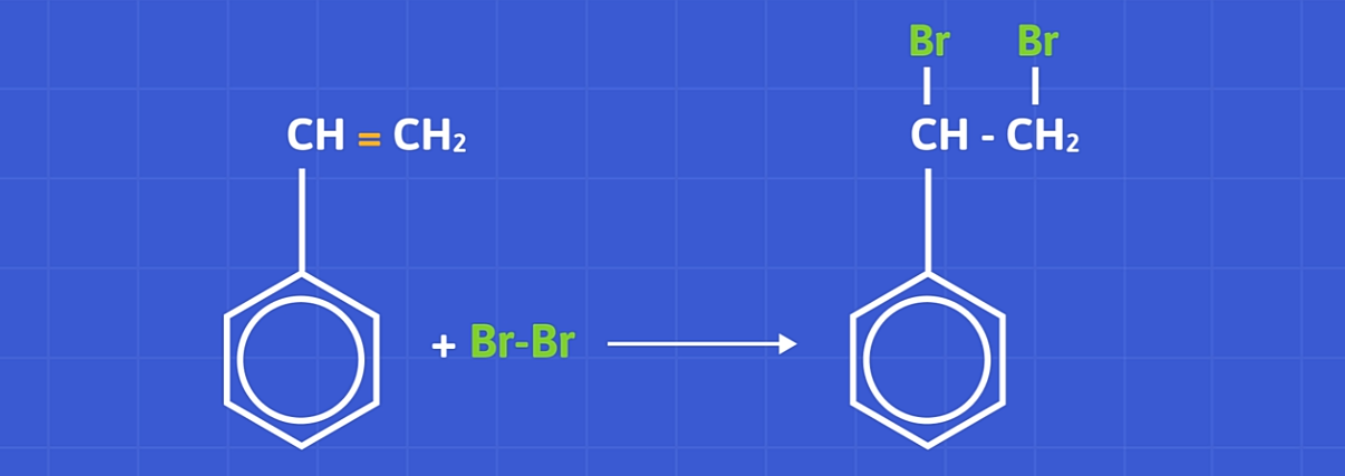
a) Phản ứng với dung dịch brom
Stiren làm mất màu dung dịch brom ở điều kiện thường giống với anken.
b) Phản ứng với hidro
Stiren phản ứng với hidro với nhiệt độ, xúc tác, và áp suất cao sẽ thu được etylxiclohexan qua hai giai đoạn.
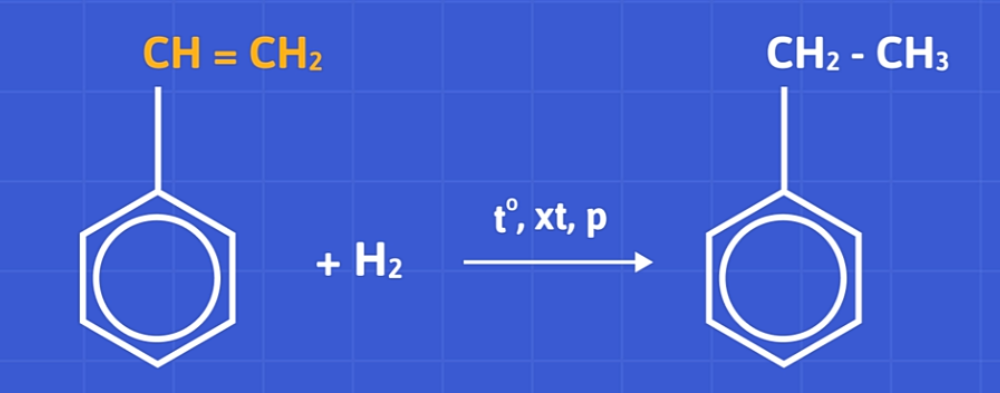
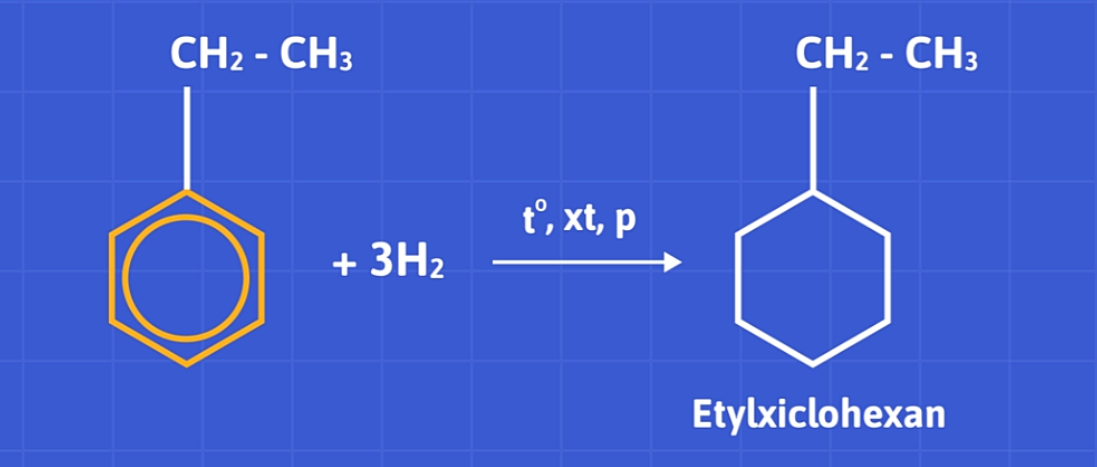
c) Phản ứng trùng hợp
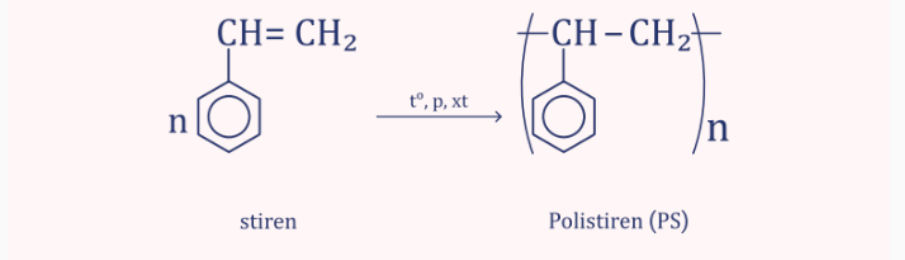
.gif)
C. ỨNG DỤNG CỦA MỘT SỐ HIDROCACBON THƠM
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cộng đồng Hoc24.vn cùng thảo luận và trả lời nhé. Chúc các em học tốt!
.gif)
.gif)