Bài 16: Tốc độ phản ứng hoá học
Nội dung lý thuyết
I. KHÁI NIỆM TỐC ĐỘ PHẢN ỨNG, TỐC ĐỘ TRUNG BÌNH CỦA PHẢN ỨNG
1. Khái niệm tốc độ phản ứng
- Khi phản ứng hoá học xảy ra, lượng chất dầu giảm dần theo thời gian, trong khi lượng chất sản phẩm tăng dần theo thời gian.
Tốc độ phản ứng của một phản ứng hoá học là đại lượng đặc trưng cho sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
- Kí hiệu: \(\upsilon\), đơn vị: (đơn vị nồng độ)(đơn vị thời gian)-1.
@3011318@
2. Tốc độ trung bình của phản ứng
- Tốc độ trung bình của phản ứng (\(\overline{\upsilon}\)) là tốc độ tính trong một khoảng thời gian phản ứng.
- Phản ứng tổng quát:
aA + bB \(\rightarrow\) mM + nN
Gọi \(\mathrm{\Delta}\)A, \(\mathrm{\Delta}\)B, \(\mathrm{\Delta}\)M, \(\mathrm{\Delta}\)N lần lượt là biến thiên lượng chất các chất A, B, M, N trong khoảng thời gian \(\mathrm{\Delta}\)t. Tốc độ phản ứng trung bình được tính theo công thức:
\(\overline{\upsilon}=-\dfrac{1}{a}\dfrac{\Delta C_A}{\Delta t}=-\dfrac{1}{b}\dfrac{\Delta C_B}{\Delta t}=\dfrac{1}{m}\dfrac{\Delta C_M}{\Delta t}=\dfrac{1}{n}\dfrac{\Delta C_N}{\Delta t}\)
II. ĐỊNH LUẬT TÁC DỤNG KHỐI LƯỢNG
- Khi nồng độ các chất tham gia phản ứng càng lớn thì tốc độ phản ứng càng lớn do tăng sự va chạm có ích giữa các phân tử chất, nồng độ càng lớn thì số lượng va chạm càng nhiều (trong cùng một đơn vị thời gian, cùng một đơn vị thể tích) nên tốc độ phản ứng càng lớn.
- Định luật tác dụng khối lượng áp dụng cho các phản ứng đơn giản, biểu thị sự phụ thuộc tốc độ phản ứng. Trong đó, phản ứng đơn giản là phản ứng chỉ diễn ra qua một giai đoạn duy nhất, chất phản ứng tạo thành sản phẩm không qua một chất trung gian nào khác.
- Phản ứng tổng quát:
aA + bB → sản phẩm
Công thức tính tốc độ phản ứng: \(\upsilon=k.C_A^a.C_B^b\)
Trong đó: \(C_A\), \(C_B\) là nồng độ mol L-1 tương ứng với chất A và B;
\(k\) là hằng số tốc độ phản ứng mà giá trị của nó chỉ phụ thuộc vào nhiệt độ và bản chất các chất tham gia phản ứng.
- Định luật tác dụng khối lượng: Tốc độ phản ứng tỉ lệ thuận với tích nồng độ các chất tham gia phản ứng với số mũ thích hợp.
II. CÁC YẾU TỐ ẢNH HƯỞNG TỚI TỐC ĐỘ PHẢN ỨNG, HỆ SỐ NHIỆT ĐỘ VAN'T HOFF
1. Ảnh hưởng của nồng độ
Nồng độ các chất phản ứng càng lớn, tốc độ phản ứng càng lớn.
Khi nồng độ chất phản ứng tăng lên, trong một đơn vị thể tích, các phân tử này cũng sẽ nhiều hơn, dẫn đến số lượng va chạm giữa chúng (trong cùng một đơn vị thời gian) tăng lên. Vì vậy tốc độ phản ứng tăng lên khi nồng độ các chất tăng.
2. Ảnh hưởng của áp suất
Áp suất của các chất phản ứng ở thể khí càng lớn, tốc độ phản ứng càng lớn.
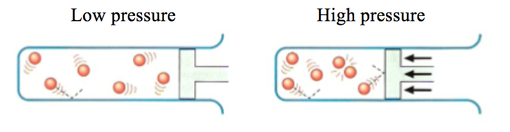
Ảnh: Hình bên trái là phản ứng có áp suất thấp, hình bên phải là phản ứng có áp suất cao hơn.
Đối với các chất khí, nồng độ của chất khí tỉ lệ với áp suất của nó. Do vậy, khi áp suất chất tham gia phản ứng ở thể khí tăng lên, sẽ làm nồng độ chất khí tăng lên, từ đó làm tăng tốc độ phản ứng.
3. Ảnh hưởng của diện tích bề mặt
Diện tích bề mặt càng lớn, tốc độ phản ứng càng lớn.
@3011382@
4. Ảnh hưởng của nhiệt độ
Nhiệt độ càng cao, tốc độ phản ứng càng lớn. Với đa số các phản ứng, khi nhiệt độ tăng 10 oC thì tốc độ phản ứng tăng từ 2 đến 4 lần. Giá trị \(\gamma=2\div4\) này được gọi là hệ số Van't Hoff.
Ảnh: Hình bên trái là phản ứng ở nhiệt độ thấp, hình bên phải là phản ứng ở nhiệt độ cao
- Mối liên hệ của hệ số Van’t Hoff với tốc độ và nhiệt độ như sau:
\(\dfrac{\upsilon_2}{\upsilon_1}=\gamma^{\left(\dfrac{T_2-T_1}{10}\right)}\)
Trong đó: \(v_{2}\) là tốc độ phản ứng tại nhiệt độ T2.
\(v_{1}\) là tốc độ phản ứng tại nhiệt độ T1.
\(\gamma\ \)là hệ số nhiệt độ Van’t Hoff
- Ý nghĩa của hệ số nhiệt độ Van’t Hoff: Giá trị \(\gamma\) càng lớn thì ảnh hưởng của nhiệt độ đến tốc độ phản ứng càng mạnh.
5. Ảnh hưởng của chất xúc tác
Chất xúc tác là chất làm tăng tốc độ phản ứng, nhưng không bị thay đổi cả về lượng và về chất sau phản ứng.
@3011451@@3011537@
Các em đã học
1. Tốc độ phản ứng của một phản ứng hoá học là đại lượng đặc trưng cho sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
2. Cách tính tốc độ trung bình \(\overline{\upsilon}\) của phản ứng: aA + bB → mM + nN
\(\overline{\upsilon}=-\dfrac{1}{a}\dfrac{\Delta C_A}{\Delta t}=-\dfrac{1}{b}\dfrac{\Delta C_B}{\Delta t}=\dfrac{1}{m}\dfrac{\Delta C_M}{\Delta t}=\dfrac{1}{n}\dfrac{\Delta C_N}{\Delta t}\)
3. Định luật tác dụng khối lượng: Tốc độ phản ứng tỉ lệ thuận với tích nồng độ các chất tham gia phản ứng với số mũ thích hợp. Với phản ứng đơn giản: aA + bB → sản phẩm, tốc độ phản ứng được tính: \(\upsilon=k.C_A^a.C_B^b\)
4. Tốc độ của phản ứng phụ thuộc vào các yếu tố: nồng độ, áp suất, diện tích bề mặt, nhiệt độ, chất xúc tác.
5. Với đa số các phản ứng, khi nhiệt độ tăng 10 oC thì tốc độ phản ứng tăng từ 2 đến 4 lần. Giá trị \(\gamma=2\div4\) này gọi là hệ số Van't Hoff, có liên hệ với tốc độ phản ứng và nhiệt độ qua biểu thức:
\(\dfrac{\upsilon_2}{\upsilon_1}=\gamma^{\left(\dfrac{T_2-T_1}{10}\right)}\)
