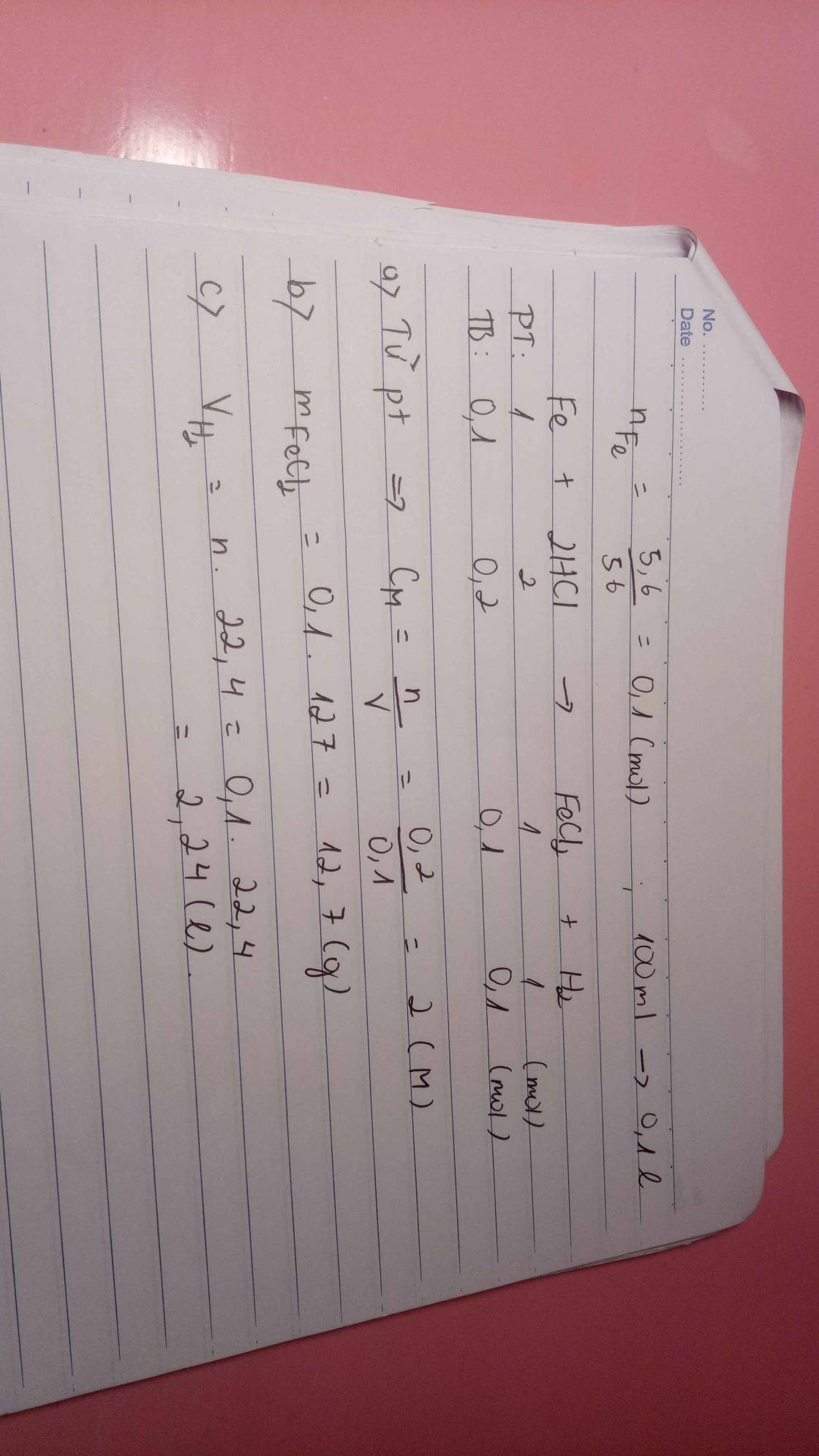Cho 6g Mg vào 100mL dung dịch HCl . Phản ứng hoàn toàn. Tính nồng độ mô HCl đã tham gia phản ứng

Những câu hỏi liên quan
Cho 1 ít viên kẽm(zinc) dư vào 100ml dung dịch acid HCl. Phản ứng xong thu được 2,479 lít khí (đkc)
a/ viết phương trình hóa học xảy ra
b/ tính khối lượng kẽm tham gia phản ứng?
c/ tính nồng độ mol của dung dịch HCl đã dùng?
Cho Zn=65, Cl=35,5, O=16, H=1
\(n_{H_2}=\dfrac{2,479}{22,4}=\dfrac{2479}{22400}mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Theo pt ta có: \(n_{Zn}=n_{H_2}=\dfrac{2479}{22400}mol\)\(\approx0,11mol\)
\(\Rightarrow m_{Zn}\approx7,2g\)
\(n_{HCl}=2n_{H_2}=0,22mol\) \(\Rightarrow C_{M_{HCl}}=\dfrac{0,22}{0,1}=2,2M\)
Đúng 0
Bình luận (0)
cho 1 lượng Mg tác dụng vừa đủ với 150ml dung dịch Hcl,sau khi xảy ra phản ứng hoàn toàn thu được 6.72 lít khí(dktc)
tính khối lượng Mg đã phản ứng
tính nồng độ mol của dung dịch Hcl đã dùng
nMg = 6,72 : 22,4 = 0,3 mol
Mg + 2HCl -> MgCl2 + H2
0,3 0,6 0,3
=> mMg = 0,3 . 24 = 7,2 g
CM HCl = 0,6 : 0,5 = 4M
Đúng 0
Bình luận (0)
Cho một lượng Magie dư vào 500ml dung dịch HCl phản ứng xong thu được 3.36 lít khí (đktc) a viết PTHH b tính khối lượng Mg đã tham gia phản ứng c tính nồng đọ mol của đe HCl đã dùng
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
a)PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
b) \(n_{Mg}=n_{H_2}=0,15\left(mol\right)\)
\(m_{Mg}=0,15.24=3,6\left(g\right)\)
c) \(n_{HCl}=2n_{H_2}=0,3\left(mol\right)\)
\(C_{M_{HCl}}=\dfrac{0,3}{0,5}=0,6\left(M\right)\)
Đúng 1
Bình luận (0)
Câu 3: Để hoà toàn 2,4gam Mg vào 100ml dung dịch HCl 2,5M
a. Viết phương trình phản ứng
b. Sau phản ứng chất nào dư? Dư bao nhiêu gam?
c. Tính nồng độ các chất có trong dung dịch sau phản ứng
Câu 3 :
\(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\)
100ml = 0,1l
\(n_{HCl}=2,5.0,1=0,25\left(mol\right)\)
a) Pt : \(Mg+2HCl\rightarrow MgCl_2+H_2|\)
1 2 1 1
0,1 0,25 0,1
b) Lập tỉ số so sánh : \(\dfrac{0,1}{1}< \dfrac{0,25}{2}\)
⇒ Mg phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol của Mg
\(n_{HCl\left(dư\right)}=0,25-\left(0,1.2\right)=0,05\left(mol\right)\)
⇒ \(m_{HCl\left(dư\right)}=0,05.36,5=1,825\left(g\right)\)
c) \(n_{MgCl2}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
\(C_{M_{MgCl2}}=\dfrac{0,1}{0,1}=1\left(M\right)\)
\(C_{M_{HCl\left(dư\right)}}=\dfrac{0,05}{0,1}=0,5\left(M\right)\)
Chúc bạn học tốt
Đúng 1
Bình luận (0)
Cho 1 lượng mạt sắt dư vào 50 ml dung dịch HCl phản ứng thu được 3.36 lít khí h2 A tính khối lượng mạt sắt tham gia phản ứng B tính nồng độ mol dung dịch HCl đã dùng
\(n_{H_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(0.15......0.3..................0.15\)
\(m_{Fe}=0.15\cdot56=8.4\left(g\right)\)
\(C_{M_{HCl}}=\dfrac{0.3}{0.05}=6\left(M\right)\)
Đúng 1
Bình luận (0)
Cho 100g dung dịch HCl phản ứng hoàn toàn với CaCO3 vừa đủ thì thu được 4.48 lít khí CO2 ( đktc)
a. Tính nồng độ % của dung dịch HCl đã dùng
b. Tính số gam CaCO3 đã tham gia phản ứng
c. Tính nồng độ % của dung dịch muối thu được sau phản ứng
nCO2=0,2mol
PTHH: 2HCl+CaCO3=>CaCl2+CO2+H2O
0,4mol<-0,2mol<-0,2mol<-0,2mol->0,2mol
=> mHCl tham gia : 0,4.36,5=14,6g
=> C%HCl=14,6:100.100=14,6%
b)mCaCO3 tham gia : 0,2.100=20g
c) m muối thu được :0,2.111=22,2g
theo định luật btoan khối lượng ta có : m(CaCl2)=mHCl+mCaCO3-mCO2-mH2o
=100+20-0,2.44-0,1.18=109,4
=> C% muối: 22,2/109,4.100=20,29%
Đúng 0
Bình luận (0)
Cho 1 khối lượng Mg dư vào 100 ml dung dịch HCL . Phản ứng xong thu được 4,48 lit H_2 o dktca ) Viết phương trình phản ứngb ) Tính khối lượng Magie đã tham gia phản ứngc) Tính nồng độ mol của dung dịch HCL đã dùngd ) Dungf lượng dung dịch HCL như trên để hòa tan hoàn toàn 15,2 g hỗn hợp bột Cuo và FeO . tính thành phần phần trăm mỗi oxit trong hỗn hợp( Cho H 1, Cu 64 , Mg 24 , Cl 35,5 , Fe 56 , O 16 )Các bạn ơi giúp mình bài tập này với
Đọc tiếp
Cho 1 khối lượng Mg dư vào 100 ml dung dịch HCL . Phản ứng xong thu được 4,48 lit \(H_2\) o dktc
a ) Viết phương trình phản ứng
b ) Tính khối lượng Magie đã tham gia phản ứng
c) Tính nồng độ mol của dung dịch HCL đã dùng
d ) Dungf lượng dung dịch HCL như trên để hòa tan hoàn toàn 15,2 g hỗn hợp bột Cuo và FeO . tính thành phần phần trăm mỗi oxit trong hỗn hợp
( Cho H= 1, Cu = 64 , Mg = 24 , Cl = 35,5 , Fe = 56 , O = 16 )
Các bạn ơi giúp mình bài tập này với
Các bạn ơi giúp tôi dj mà đây là đề thj của trường tôi đó
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Cho 5,6g Fe phản ứng hoàn toàn với 100ml dung dịch HCl phản ứng xảy ra hoàn toàn a. Xác định nồng độ dung dịch HCl cần dùng b. Xác định khối lượng muối thu được sau phản ứng c. Xác định thể tích Hidro thu được sau phản ứng
Để giải bài toán này, ta cần biết phương trình phản ứng giữa Fe và HCl: Fe + 2HCl -> FeCl2 + H2 a. Để xác định nồng độ dung dịch HCl cần dùng, ta cần tính số mol của Fe. Đầu tiên, ta cần chuyển khối lượng Fe thành số mol bằng cách sử dụng khối lượng mol của Fe (56g/mol): Số mol Fe = khối lượng Fe / khối lượng mol Fe = 5,6g / 56g/mol = 0,1 mol Vì theo phương trình phản ứng, 1 mol Fe tương ứng với 2 mol HCl, nên số mol HCl cần dùng là gấp đôi số mol Fe: Số mol HCl = 2 x số mol Fe = 2 x 0,1 mol = 0,2 mol Để tính nồng độ dung dịch HCl, ta chia số mol HCl cho thể tích dung dịch HCl: Nồng độ HCl = số mol HCl / thể tích dung dịch HCl = 0,2 mol / 0,1 L = 2 mol/L Vậy, nồng độ dung dịch HCl cần dùng là 2 mol/L. b. Để xác định khối lượng muối thu được sau phản ứng, ta cần tính số mol muối FeCl2. Theo phương trình phản ứng, 1 mol Fe tương ứng với 1 mol FeCl2, nên số mol muối FeCl2 cũng là 0,1 mol. Khối lượng muối FeCl2 = số mol muối FeCl2 x khối lượng mol muối FeCl2 = 0,1 mol x (56g/mol + 2 x 35,5g/mol) = 0,1 mol x 127g/mol = 12,7g Vậy, khối lượng muối thu được sau phản ứng là 12,7g. c. Để xác định thể tích Hidro thu được sau phản ứng, ta cần tính số mol H2. Theo phương trình phản ứng, 1 mol Fe tương ứng với 1 mol H2, nên số mol H2 cũng là 0,1 mol. Thể tích H2 = số mol H2 x thể tích mol của H2 = 0,1 mol x 22,4 L/mol = 2,24 L Vậy, thể tích Hidro thu được sau phản ứng là 2,24 L.
Đúng 1
Bình luận (0)
a, \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{HCl}=2n_{Fe}=0,2\left(mol\right)\Rightarrow C_{M_{HCl}}=\dfrac{0,2}{0,1}=2\left(M\right)\)
b, \(n_{FeCl_2}=n_{H_2}=n_{Fe}=0,1\left(mol\right)\)
\(\Rightarrow m_{FeCl_2}=0,1.127=12,7\left(g\right)\)
c, \(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
Đúng 1
Bình luận (0)
Câu 3. Cho 4g MgO tác dụng hoàn toàn với 100ml dung dịch HCl nồng độ 4M.
a. Sau phản ứng chất nào dư? Dư bao nhiêu gam?
b. Tính nồng độ mol (CM) các dung dịch thu được sau phản ứng.
Ta có: \(n_{MgO}=\dfrac{4}{40}=0,1\left(mol\right)\)
\(n_{HCl}=4.100:1000=0,4\left(mol\right)\)
a. PTHH: MgO + 2HCl ---> MgCl2 + H2O
Ta thấy: \(\dfrac{0,1}{1}< \dfrac{0,4}{2}\)
Vậy HCl dư.
=> \(n_{dư}=\dfrac{0,1.2}{0,4}=0,5\left(mol\right)\)
=> \(m_{dư}=0,5.36,5=18,2\left(g\right)\)
b. Ta có: \(V_{dd_{MgCl_2}}=V_{HCl}=\dfrac{100}{1000}=0,1\left(lít\right)\)
Theo PT: \(n_{MgCl_2}=n_{MgO}=0,1\left(mol\right)\)
=> \(C_{M_{MgCl_2}}=\dfrac{0,1}{0,1}=1M\)
Đúng 1
Bình luận (1)
: Cho 3 g Mg vào 100 mL dung dịch HCl nồng độ 1M. Phản ứng xảy ra hoàn toàn. theo sơ đồ sau:Mg + HCl - MgCl2 +H2a) Tính thể tích khí thoát ra .b) Tính nồng độ MgCl2 trong dung dịch thu được. Coi thể tích dung dịch không đổi sau phản ứng.c) Tính khối lượng MgCl2 thu được biết hiệu suất phản ứng là 90%
Đọc tiếp
: Cho 3 g Mg vào 100 mL dung dịch HCl nồng độ 1M. Phản ứng xảy ra hoàn toàn. theo sơ đồ sau:
Mg + HCl -> MgCl2 +H2
a) Tính thể tích khí thoát ra .
b) Tính nồng độ MgCl2 trong dung dịch thu được. Coi thể tích dung dịch không đổi sau phản ứng.
c) Tính khối lượng MgCl2 thu được biết hiệu suất phản ứng là 90%