Hãy dự đoán và viết phương trình hóa học của phản ứng khi cho kim loại đồng vào dung dịch AgNO3.

Những câu hỏi liên quan
Nêu hiện tượng và viết phương trình hóa học phản ứng xảy ra khi ngâm một mẫu khim loại đồng trong dung dịch AgNO3 dư một thời gian.
Hiện tượng : một phần đinh sắt bị hòa tan , có chất rắn màu nâu đỏ bám vào đinh sắt , màu xanh lam của dung dịch CuSO4 ban đầu nhạt dần
Pt : \(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
Chúc bạn học tốt
Đúng 2
Bình luận (0)
Ngâm một vật bằng đồng có khối lượng 10g trong 250g dung dịch AgNO3 4% khi lấy vật ra thì khối lượng AgNO3 trong dung dịch giảm 17%.
Viết phương trình hóa học của phản ứng và cho biết vai trò các chất tham gia phản ứng.
2AgNO3 + Cu → Cu(NO3)2 + 2Ag
Phương trình ion thu gọn: Cu + 2Ag+ → Cu2+ + 2Ag↓
AgNO3 là chất oxi hóa, Cu là chất khử.
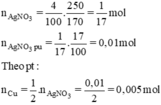
Áp dụng tăng giảm khối lượng
Đúng 0
Bình luận (0)
Hòa tan 10gam hỗn hợp hai kim loại đồng và sắt vào dung dịch axit clohiđric , sau phản ứng thu được 3,36 lit khí (đktc) . a) Viết phương trình của Hóa Học của phản ứng xảy ra .b) Tính khối lượng của mỗi kim loại trong hỗn hợp ban đầu .c) Cho hỗn hợp hai kim loại trên vào dung dịch axit sunfuric đặc nóng thì có những phản ứng nào xảy ra ? Viết phương trình Hóa Học của phản ứng ?
Đọc tiếp
Hòa tan 10gam hỗn hợp hai kim loại đồng và sắt vào dung dịch axit clohiđric , sau phản ứng thu được 3,36 lit khí (đktc) .
a) Viết phương trình của Hóa Học của phản ứng xảy ra .
b) Tính khối lượng của mỗi kim loại trong hỗn hợp ban đầu .
c) Cho hỗn hợp hai kim loại trên vào dung dịch axit sunfuric đặc nóng thì có những phản ứng nào xảy ra ? Viết phương trình Hóa Học của phản ứng ?
a) Fe +2HCl---> FeCl2 + H2
Cu ko pư nha
nh2= 3.36/22,4=0,15 mol
thế mol h2 vào phương trình ta được
nh2=nfe=0.15
có mol hết rồi thì bạn tìm mfe=0.15x56=8.4(gam)
mcu=mhh-mfe=10-8.4=1.6(gam)
Đúng 3
Bình luận (0)
Vì đồng không tác dụng với HCl loãng :
\(n_{H2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
a) Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,15 0,15
b) \(n_{Fe}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
\(m_{Fe}=0,15.56=8,4\left(g\right)\)
\(m_{Cu}=10-8,4=1,6\left(g\right)\)
c) Cả hai chất đều xảy ra phản ứng :
Pt : \(Cu+H_2SO_{4đặc}\underrightarrow{t^o}CuSO_4+SO_2+H_2O\)
\(2Fe+6H_2SO_{4đặc}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
Chúc bạn học tốt
Đúng 0
Bình luận (1)
b) thì chỉ có Cu tác dụng với H2SO4đặc nóng. fe ko phản ứng được
PTHH : Cuo + h2so4 ----> cuso4 + so2 + h2o
Đúng 3
Bình luận (0)
Xem thêm câu trả lời
Axit fomic tác dụng với AgNO3 trong dung dịch NH3 tạo ra kết tủa bạc kim loại. Dựa vào cấu tạo phân tử của axit fomic để giải thích, viết phương trình hóa học của phản ứng.
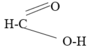
Do trong phân tử HCOOH có nhóm –CHO nên HCOOH phản ứng với AgNO3/NH3 như là một anđehit.
HCOOH + 2AgNO3 + 4NH3 + H2O → (NH4)2CO3 + 2Ag + 2NH4NO3
Đúng 0
Bình luận (0)
Hãy gải thích hiện tượng hoá học xảy ra và viết các phương trình phản ứng khi tiến hành các thí nghiệm sau: a; Cho mẫu bari kim loại vào dung dịch muối Đồng (II) clorua b; Cho mẫu đoòng vào H2So4 đậm đặc nóng.
a. Hiện tượng: Bari chạy trên mặt nước, có khí không màu thoát ra, sau đó có kết tủa xanh tạo thành.
\(PTHH:\)
\(Ba+2H_2O--->Ba\left(OH\right)_2+H_2\)
\(Ba\left(OH\right)_2+CuCl_2--->Cu\left(OH\right)_2\downarrow+BaCl_2\)
b. Hiện tượng: Đường từ màu trắng dần chuyển sang màu đen, sau đó phần màu đen dần phồng lên.
PTHH:
\(C_{12}H_{22}O_{11}\overset{H_2SO_{4_{đặc}}}{--->}12C+11H_2O\)
\(C+2H_2SO_{4_đ}--->CO_2+2SO_2+2H_2O\)
Đúng 1
Bình luận (0)
Hãy nêu hiện tượng và viết phương trình phản ứng hóa học để giải thích khi tiến hành thí nghiệm sau:
Nhỏ từ từ đến dư dung dịch KOH vào một mẩu kim loại Al ta được dung dịch A. Nhỏ từ từ vài giọt dung dịch phenolphthalein vào dung dịch A, sau đó nhỏ từ từ đến dư dung dịch HCl vào dung dịch A
giúp tớ với ạ:(((
ban đầu xuất hiện kết tủa trắng keo nhưng sau đó bị KOH dư hòa tan tạo dd trong suốt
3KOH+ AlCl3 => Al(OH)3+3KCl
KOH+Al(OH)3=>KAlO2 +2H2O
Sau đó nhỏ phenol vào dd xuất hiện màu hồng
sau khi nhỏ HCl thì màu hồn nhạ đi r dd trong suốt
Đúng 3
Bình luận (0)
Cho kim loại magie vào dung dịch axit clohidric 20%, sau khi kết thúc phản ứng thu
được 4,48 lít khí X ( điều kiện tiêu chuẩn) và dung dịch Y.
a/ Viết phương trình hóa học xảy ra.
b/ Tính khối lượng magie đã phản ứng ?
c/ Tính khối lượng dung dịch axit clohidric 20% đã dùng.
d/ Tính nồng độ phần trăm của dung dịch Y.
Cho: H = 1 ; Mg = 24 ; Cl = 35,5
Bài 4: Cho 4,8 gam kim loại magnesium(Mg) vào 200 gam dung dịch Hydrochloric acid (HCl). Khi phản ứng kết thúc thu được dung dịch muối magnesium chloride (MgCl2) và thấy thoát ra 0,4 gam khí Hydrogen.
a) Lập phương trình hóa học của phản ứng.
b)Viết công thức định luật bảo toàn khối lượng cho phản ứng.
c) Hãy tính khối lượng dung dịch muối magnesium chloride (MgCl2) thu được.
a) \(PTHH:Mg+2HCL\) → \(MgCl_2+H_2\)
b) Theo định luật bảo toàn khối lượng
⇒ \(m_{Mg}+m_{HCl}=m_{MgCl_2}+m_{H_2}\)
c) ⇒ \(4,8+200=m_{MgCl_2}+0,4\)
⇒ \(m_{MgCl_2}=204,4\left(g\right)\)
Đúng 3
Bình luận (0)
Bài 4: Cho 9,6 gam kim loại magnesium(Mg) vào 300 gam dung dịch Hydrochloric acid (HCl). Khi phản ứng kết thúc thu được dung dịch muối magnesium chloride (MgCl2) và thấy thoát ra 0,8 gam khí Hydrogen.
a) Lập phương trình hóa học của phản ứng.
b)Viết công thức định luật bảo toàn khối lượng cho phản ứng.
c) Hãy tính khối lượng dung dịch muối magnesium chloride (MgCl2) thu được
a, PTHH : \(Mg+2HCl -> MgCl_2+H_2\)
b/ Công thức ĐLBTLKL: \(m_{Mg}+m_{HCl}=m_{MgCl_2}+m_{H_2}\)
c/ Áp dụng ĐLBTKL, ta có: \(m_{Mg}+m_{HCl}=m_{MgCl_2}+m_{H_2}\)
\(=> m_{MgCl_2}=(9,6+300)-0,8=308,8(g)\)
Vậy khối lượng \(MgCl_2\) thu được là \(308,8 g \)
Đúng 1
Bình luận (13)
a) PTHH: Mg + 2HCl -> MgCl2 + H2
b) Theo ĐLBTKL
\(m_{Mg}+m_{HCl}=m_{MgCl_2}+m_{H_2}\\ =>9,6+300=m_{MgCl_2}+0,8\)
c) Khối lượng MgCl2 thu dc là
\(m_{MgCl_2}=309,6-0,8=308,8\left(g\right)\)
Đúng 1
Bình luận (0)
cho 5,4 gam kim loại nhôm vào dung dịch có chứa 7,3gam axit clohiddric
a)viết phương trình hóa học xảy ra
b)tìm khối lượng của các chất sau khi phản ứng kết thúc
\(n_{Al}=\dfrac{5,4}{27}=0,2mol\)
\(n_{HCl}=\dfrac{7,3}{36,5}=0,2mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\dfrac{0,2}{2}\) > \(\dfrac{0,2}{6}\) ( mol )
1/15 0,2 1/15 0,1 ( mol )
\(m_{AlCl_3}=\dfrac{1}{15}.13,5=8,9g\)
\(m_{H_2}=0,1.2=0,2g\)
\(m_{Al\left(dư\right)}=\left(0,2-\dfrac{1}{15}\right).27=3,6g\)
Đúng 2
Bình luận (0)

























