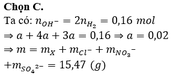hòa tan hoàn toàn 21,6 gam kim loại M bằng dung dịch HNO3 thu đượ 5,6 lít hỗn hợp khí A nặng 7,2 gam gồm NO và N2 và dung dịch không chứa muối amoni,kim loại M là

Những câu hỏi liên quan
Hòa tan hoàn toàn m gam hỗn hợp A gồm Fe và kim loại M ( hóa trị không đổi) trong dung dịch HCl dư, thu được 1,008 lít khí (đktc) và dung dịch chứa 4,575 gam muối. 1. Tính khối lượng m. 2. Hòa tan hết m gam hỗn hợp A trong dung dịch chứa đồng thời hai axit: HNO3 ( đặc) và H2SO4 ( khi đun nóng) thu được 1,8816 lít hỗn hợp B gồm 2 khí (đktc). Tỉ khối của hỗn hợp B so với H2 bằng 25,25. Xác định kim loại M biết rằng trong dung dịch tạo thành không chứa muối amoni.
Đọc tiếp
Hòa tan hoàn toàn m gam hỗn hợp A gồm Fe và kim loại M ( hóa trị không đổi) trong dung dịch HCl dư, thu được 1,008 lít khí (đktc) và dung dịch chứa 4,575 gam muối.
1. Tính khối lượng m.
2. Hòa tan hết m gam hỗn hợp A trong dung dịch chứa đồng thời hai axit: HNO3 ( đặc) và H2SO4 ( khi đun nóng) thu được 1,8816 lít hỗn hợp B gồm 2 khí (đktc). Tỉ khối của hỗn hợp B so với H2 bằng 25,25. Xác định kim loại M biết rằng trong dung dịch tạo thành không chứa muối amoni.
Câu 1
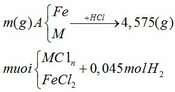
Áp dụng định luật bảo toàn nguyên
tố H ta có:
nHCl = 2nH2 = 2.0,045 = 0,09 mol
Áp dụng định luật bảo toàn khối lượng
ta có: mA + mHCl = m muối + mH2
=> m = m muối + mH2 – mA = 4,575 + 0,045.2 – 0,09.36,5 = 1,38 (gam)
Câu 2
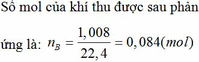
Do cho kim loại phản ứng với H2SO4 đặc và HNO3 đặc nên khí sinh ra là SO2 và NO2.
Áp dụng phương pháp đường chéo ta có:
SO2: 64 4,5
50,5
NO2: 46 13,5
→nSO2=nNO2=4,513,5=13
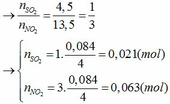
Đặt số mol của Fe và M lần lượt là x và y (mol)
- Khi cho hỗn hợp tác dụng với HCl:
Fe + 2HCl → FeCl2 + H2
x x (mol)
M + nHCl → MCln + 0,5nH2
y 0,5ny (mol)
nH2 = 0,045 => x + 0,5ny = 0,045 (1)
- Khi cho hỗn hợp tác dụng với HNO3 đặc và H2SO4 đặc:
Ta có các bán phản ứng oxi hóa – khử:
Fe → Fe3+ + 3e
x 3x
M → Mn+ + ne
y ny
S+6 + 2e → S+4 (SO2)
0,021 0,042
N+5 + 1e → N+4 (NO2)
0,063 0,063
Áp dụng định luật bảo toàn electron ta có: 3x + ny = 0,042 + 0,063 hay 3x + ny = 0,105 (2)
Từ (1) và (2) ta có hệ phương trình sau:
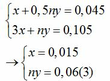
Mặt khác: mA = mFe + mM => 1,38 = 0,015.56 + My => My = 0,54(4)
Từ (3) và (4) suy ra M = 9n
Ta có bảng sau:
| n |
1 |
2 |
3 |
| M |
9 (loại) |
18 (loại) |
27 (nhận) |
Vậy kim loại M là nhôm, kí hiệu là Al.
Đúng 0
Bình luận (0)
Hòa tan hết m gam bột nhôm kim loại bằng dung dịch
H
N
O
3
, thu được dung dịch X không chứa muối amoni và 1,12 lít hỗn hợp khí gồm
N
2
v
à
N
2
O
có tỉ khối so với He bằng 10,2. Giá trị của m là A. 3,78 B. 4,32. C. 1,89. D. 2,16.
Đọc tiếp
Hòa tan hết m gam bột nhôm kim loại bằng dung dịch H N O 3 , thu được dung dịch X không chứa muối amoni và 1,12 lít hỗn hợp khí gồm N 2 v à N 2 O có tỉ khối so với He bằng 10,2. Giá trị của m là
A. 3,78
B. 4,32.
C. 1,89.
D. 2,16.
Đ á p á n A n N 2 + n N 2 O = 0 , 05 28 n N 2 + 44 n N 2 O = 10 , 2 . 4 . 0 , 05 = 2 , 04 ⇒ n N 2 = 0 , 01 n N 2 O = 0 , 04 B T e : 3 n A l = 10 n N 2 + 8 n N 2 O ⇒ n A l = 0 , 14 m o l m A l = 3 , 78 g
Đúng 0
Bình luận (0)
Hòa tan hết m gam bột nhôm kim loại bằng dung dịch HNO3 thu được dung dịch A không chứa muối amoni và 1,12 lít hỗn hợp khí gồm N2 và N2O có tỉ khối so với He bằng 10,2. Khối lượng ban đầu m có giá trị bằng A. 3,78 gam. B. 4,32 gam. C. 1,89 gam. D. 2.16 gam.
Đọc tiếp
Hòa tan hết m gam bột nhôm kim loại bằng dung dịch HNO3 thu được dung dịch A không chứa muối amoni và 1,12 lít hỗn hợp khí gồm N2 và N2O có tỉ khối so với He bằng 10,2. Khối lượng ban đầu m có giá trị bằng
A. 3,78 gam.
B. 4,32 gam.
C. 1,89 gam.
D. 2.16 gam.
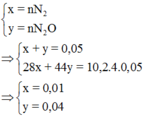
Bảo toàn ne ⇒ 3nAl = 10nN2 + 8nN2O ⇒ nAl = 0,14 ⇒ m = 0,14.27 = 3,78 ⇒ Chọn A.
Đúng 0
Bình luận (0)
Hỗn hợp X gồm hai kim loại kiềm thổ và một kim loại kiềm. Hòa tan hoàn toàn 7,2 gam X vào nước, thu được dung dịch Y và 1,792 lít khí H2. Dung dịch Z gồm a mol HCl, 2a mol H2SO4 và 3a mol HNO3. Trung hòa dung dịch Y bằng dung dịch Z tạo ra m gam hỗn hợp muối. Giá trị của m là A. 14,490 B. 11,335 C. 15,470 D. 23,740
Đọc tiếp
Hỗn hợp X gồm hai kim loại kiềm thổ và một kim loại kiềm. Hòa tan hoàn toàn 7,2 gam X vào nước, thu được dung dịch Y và 1,792 lít khí H2. Dung dịch Z gồm a mol HCl, 2a mol H2SO4 và 3a mol HNO3. Trung hòa dung dịch Y bằng dung dịch Z tạo ra m gam hỗn hợp muối. Giá trị của m là
A. 14,490
B. 11,335
C. 15,470
D. 23,740
Hòa tan hết m gam bột nhôm kim loại bằng dung dịch HNO3 thu được dung dịch A không chứa muối amoni và 1,12 lít khí N2 ở đktc. m có giá trị là A. 4,5 B. 4,32 C. 1,89 D. 2,16
Đọc tiếp
Hòa tan hết m gam bột nhôm kim loại bằng dung dịch HNO3 thu được dung dịch A không chứa muối amoni và 1,12 lít khí N2 ở đktc. m có giá trị là
A. 4,5
B. 4,32
C. 1,89
D. 2,16
Đáp án A
Bảo toàn ne =>3nAl = 10nN2 =>nAl = 1/6 => mAl = 4,5g
Đúng 0
Bình luận (0)
Hòa tan hết m gam bột nhôm kim loại bằng dung dịch HNO3 thu được dung dịch A không chứa muối amoni và 1,12 lít khí N2 ở đktC. m có giá trị là A. 4,5. B. 4,32. C. 1,89. D. 2,16.
Đọc tiếp
Hòa tan hết m gam bột nhôm kim loại bằng dung dịch HNO3 thu được dung dịch A không chứa muối amoni và 1,12 lít khí N2 ở đktC. m có giá trị là
A. 4,5.
B. 4,32.
C. 1,89.
D. 2,16.
Bảo toàn ne ⇒3nAl = 10nN2⇒ nAl = 1/6 ⇒ mAl = 4,5g ⇒ Chọn A.
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 7,15 gam kim loại M vào lượng dư dung dịch HNO3 loãng, thu được 0,448 lít (đktc) hỗn hợp 2 khí không màu, không hóa nâu trong không khí và dung dịch chứa 21,19 gam muối. Kim loại M là A. Fe B. Al C. Ag D. Zn
Đọc tiếp
Hòa tan hoàn toàn 7,15 gam kim loại M vào lượng dư dung dịch HNO3 loãng, thu được 0,448 lít (đktc) hỗn hợp 2 khí không màu, không hóa nâu trong không khí và dung dịch chứa 21,19 gam muối. Kim loại M là
A. Fe
B. Al
C. Ag
D. Zn
Hòa tan hoàn toàn 11,1 gam hỗn hợp gồm Fe và kim loại X hóa trị không đổi bằng dung dịch HCl, thu được 6,72 lít khí
H
2
. Mặt khác, hòa tan hoàn toàn 11,1 gam hỗn hợp trên bằng dung dịch
HNO
3
loãng (dư), thu được 5,6 lít khí NO (sản phẩm khử duy nhất). Biết các thể tích khí đều đo ở điều kiện tiêu chuẩn. Kim loại X là A. Zn B. Al C. Cr D. Mg
Đọc tiếp
Hòa tan hoàn toàn 11,1 gam hỗn hợp gồm Fe và kim loại X hóa trị không đổi bằng dung dịch HCl, thu được 6,72 lít khí H 2 . Mặt khác, hòa tan hoàn toàn 11,1 gam hỗn hợp trên bằng dung dịch HNO 3 loãng (dư), thu được 5,6 lít khí NO (sản phẩm khử duy nhất). Biết các thể tích khí đều đo ở điều kiện tiêu chuẩn. Kim loại X là
A. Zn
B. Al
C. Cr
D. Mg
Hòa tan hoàn toàn 7,15 gam kim loại M hóa trị 2 vào lượng dư dung dịch HNO3 loãng, thu được 0,448 lít(đktc) hỗn hợp 2 khí không màu, không hóa nâu trong không khí (số mol hai khí bằng nhau) và dung dịch chứa 21,19 gam muối. Kim loại M là:
A. Fe
B. Ca
C. Mg
D. Zn
2 khí không màu, không hóa nâu trong không khí và là sản phẩm khử của N+5 chỉ có thể là N2 và N2O
-TH1: 21,19 gam muối không có muối NH4NO3
Theo bảo toàn nguyên tố M ta có: nM= nM(NO3)2
→ m M m M ( N O 3 ) 2 = M M M M ( N O 3 ) 2 → 7 , 15 21 , 19 = M M + 62 , 2
→M= 63,148 Loại
Do đó trường hợp này loại
-TH2: 21,19 gam muối có muối NH4NO3
QT cho e:
M → M2++ ne (1)
7,15/M 7,15.2/M
QT nhận e : nkhí= 0,02 mol. Mà số mol hai khí bằng nhau nên n N 2 O = n N 2 =0,01mol
2NO3-+ 8e+ 10H+ → N2O + 5H2O (2)
0,08 0,1 ← 0,01 mol
2NO3-+ 10e+12H+→ N2+ 6H2O (3)
0,1 0,12← 0,01 mol
NO3-+ 8e + 10H+ → NH4+ + 3H2O (4)
8x xmol
Đặt số mol muối NH4+ là x mol
Theo ĐL BT e: ne cho= ne nhận nên 7,15.2/M= 0,08 + 0,1+8x (*1)
Mặt khác : mmuối= mM(NO3)2+ mNH4NO3= 7,15/M. (M+124)+80x= 21,19 (*2)
Từ (*1) và (*2) ta có: x= 5.10-3 và M=65. M là Zn
Đáp án D
Đúng 0
Bình luận (0)