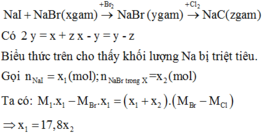Hòa tan hoàn toàn 11,7 (g) K vào 156,6 (g) nước. Tính C% dung dịch thu được

Những câu hỏi liên quan
Câu 5. Cho 23,4 g K vào nước được 5 lit dung dịch có D 1,11 g/mla. Tính C%b. Tính CM của dung dịch thu được.Câu 6. Hòa tan hoàn toàn 21,6 g Al vào dung dịch HCl, dẫn khí thu được đi qua bột Cu0 dư nung nóng. Tính khối lượng Cu thu được biết hiệu suất phản ứng là 60%.Câu 7. Đốt cháy H2 ngoài không khí tính:a. V không khí khi biết khối lượng H2 là 6 gb. Khối lượng nước thu được , biết số mol H2 là 3 và hiệu suất phản ứng là 40% c. Hiệu suất phản ứng biết khối lượng H2 đã lấy là 8g và thu được...
Đọc tiếp
Câu 5. Cho 23,4 g K vào nước được 5 lit dung dịch có D = 1,11 g/ml
a. Tính C%
b. Tính CM
của dung dịch thu được.
Câu 6. Hòa tan hoàn toàn 21,6 g Al vào dung dịch HCl, dẫn khí thu được đi qua bột Cu0 dư nung nóng. Tính khối lượng Cu thu được biết hiệu suất phản ứng là 60%.
Câu 7. Đốt cháy H2 ngoài không khí tính:
a. V không khí khi biết khối lượng H2 là 6 g
b. Khối lượng nước thu được , biết số mol H2 là 3 và hiệu suất phản ứng là 40%
c. Hiệu suất phản ứng biết khối lượng H2 đã lấy là 8g và thu được 54 g nước
Câu 6. Hòa tan hoàn toàn 21,6 g Al vào dung dịch HCl, dẫn khí thu được đi qua bột Cu0 dư nung nóng. Tính khối lượng Cu thu được biết hiệu suất phản ứng là 60%.
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(H_2+CuO\rightarrow Cu+H_2O\)
\(n_{H_2}=\dfrac{3}{2}n_{Al}=1,2\left(mol\right)\)
\(n_{Cu}=n_{H_2}=1,2\left(mol\right)\)
Vì H=60%
=> \(m_{Cu}=1,2.64.60\%=46,08\left(g\right)\)
Đúng 3
Bình luận (0)
5) \(K+H_2O\rightarrow KOH+\dfrac{1}{2}H_2\)
\(m_{dd}=5000.1,11=5550\left(g\right)\)
\(n_K=\dfrac{23,4}{39}=0,6\left(mol\right)=n_{KOH}\)
\(C\%_{KOH}=\dfrac{0,6.56}{5550}.100=0,61\%\)
\(CM_{KOH}=\dfrac{0,6}{5}=0,12M\)
Đúng 3
Bình luận (0)
Câu 7. Đốt cháy H2 ngoài không khí tính:
a. V không khí khi biết khối lượng H2 là 6 g
\(H_2+\dfrac{1}{2}O_2\rightarrow H_2O\)
\(n_{H_2}=\dfrac{6}{2}=3\left(mol\right)\)
\(n_{O_2}=\dfrac{1}{2}n_{H_2}=1,5\left(mol\right)\)
Trong không khí có 20% O2
=> \(V_{kk}=\dfrac{1,5}{20\%}.22,4=168\left(l\right)\)
b. Khối lượng nước thu được , biết số mol H2 là 3 và hiệu suất phản ứng là 40%
\(n_{H_2O}=n_{H_2}=3\left(mol\right)\)
Vì H=40%
=> \(m_{H_2O}=3.18.40\%=21,6\left(g\right)\)
c. Hiệu suất phản ứng biết khối lượng H2 đã lấy là 8g và thu được 54 g nước
\(n_{H_2}=\dfrac{8}{2}=4\left(mol\right)\)
\(n_{H_2O\left(lt\right)}=n_{H_2}=4\left(mol\right)\)
=> \(m_{H_2O\left(lt\right)}=4.18=72\left(g\right)\)
Mà thực tế chỉ thu được 54g nước
=> \(H=\dfrac{54}{72}.100=75\%\)
Đúng 3
Bình luận (0)
hòa tan hoàn toàn 3,1 g Na2O vào nước để thu được 350 g dung dịch tính C% của dd thu được
Na2O+H2O->2NaOH
0,05-------------------0,1 mol
n Na2O=0,05 mol
=>C% NaOH=\(\dfrac{0,1.40}{3,1+350}.100=1,13\%\)
Đúng 2
Bình luận (0)
\(n_{Na_2O}=\dfrac{3,1}{62}=0,05\left(mol\right)\)
PTHH: Na2O + H2O ---> 2NaOH
0,05----------------->0,1
=> \(C\%_{NaOH}=\dfrac{0,1.40}{350}.100\%=1,143\%\)
Đúng 1
Bình luận (0)
\(C\%=\dfrac{3,1}{350}.100\%=0,886\%\)
Đúng 1
Bình luận (1)
Xem thêm câu trả lời
Hòa tan hoàn toàn 22,95 g BaO vào nước được dung dịch A.a/ Sục từ luồng khí CO2 từ từ vào dung dịch A, sau khi kết thúc thí nghiệm thu được 19,7 g kết tủa. Tính thể tích khí CO2 đã phản ứng ( ở đktc)b/ Hòa tan hoàn toàn 8,4 g hôn hợp X CaCO3, MgCO3 bằng dung dịch HCl thu được khí B. Nếu cho khí B hấp thụ hoàn toàn vào dung dịch A thì có kết tủa xuất hiện không? Giải thích.
Đọc tiếp
Hòa tan hoàn toàn 22,95 g BaO vào nước được dung dịch A.
a/ Sục từ luồng khí CO2 từ từ vào dung dịch A, sau khi kết thúc thí nghiệm thu được 19,7 g kết tủa. Tính thể tích khí CO2 đã phản ứng ( ở đktc)
b/ Hòa tan hoàn toàn 8,4 g hôn hợp X CaCO3, MgCO3 bằng dung dịch HCl thu được khí B. Nếu cho khí B hấp thụ hoàn toàn vào dung dịch A thì có kết tủa xuất hiện không? Giải thích.
\(n_{BaO}=\dfrac{22.95}{153}=0.15\left(mol\right)\)
\(BaO+H_2O\rightarrow Ba\left(OH\right)_2\)
\(0.15.......................0.15\)
\(a.\) TH1 : Chỉ tạo ra BaCO3 . Ba(OH)2
\(n_{BaCO_3}=\dfrac{19.7}{197}=0.1\left(mol\right)\)
\(Ba\left(OH\right)_2+CO_2\rightarrow BaCO_3+H_2O\)
\(.............0.1......0.1\)
TH2 : Tạo ra 2 muối
\(Ba\left(OH\right)_2+CO_2\rightarrow BaCO_3+H_2O\)
\(Ba\left(OH\right)_2+2CO_2\rightarrow Ba\left(HCO_3\right)_2\)
\(\sum n_{CO_2}=0.1+\left(0.15-0.1\right)\cdot2=0.2\left(mol\right)\)
\(\text{Khi đó : }\) \(2.24\le V_{CO_2}\le4.48\)
\(b.\)
\(CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\)
\(MgCO_3+2HCl\rightarrow MgCl_2+CO_2+H_2O\)
\(n_{CO_2}=n_{MgCO_3}+n_{BaCO_3}=a\left(mol\right)\)
\(TC:\)
\(\dfrac{8.4}{100}< a< \dfrac{8.4}{8.4}=0.1\)
\(\Rightarrow n_{CO_2}:n_{Ba\left(OH\right)_2}< 0.1:0.15=0.67\)
=> Không thu được kết tủa.
Đúng 3
Bình luận (1)
B1: Hòa tan hoàn toàn 2,3 (g) Na vào 200 (g) nước thu được dung dịch NaOH và V(l) khí H2 (đktc).
a) Tính V?
b) Tính C% của dung dịch thu được sau phản ứng?
c) Cho quỳ tím vào dung dịch thu được sau phản ứng thì quỳ tím chuyển màu gì?
a, \(2Na+2H_2O\rightarrow2NaOH+H_2\)
Ta có: \(n_{Na}=\dfrac{2,3}{23}=0,1\left(mol\right)\)
\(n_{H_2O}=\dfrac{200}{18}=\dfrac{100}{9}\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,1}{2}< \dfrac{\dfrac{100}{9}}{2}\), ta được H2O dư.
Theo PT: \(n_{H_2}=\dfrac{1}{2}n_{Na}=0,05\left(mol\right)\Rightarrow V_{H_2}=0,05.22,4=1,12\left(l\right)\)
b, Theo PT: \(n_{NaOH}=n_{Na}=0,1\left(mol\right)\)
Ta có: m dd sau pư = 2,3 + 100 - 0,05.2 = 102,2 (g)
\(\Rightarrow C\%_{NaOH}=\dfrac{0,1.40}{102,2}.100\%\approx3,91\%\)
c, - Dung dịch làm quỳ tím hóa xanh.
Đúng 0
Bình luận (2)
\(n_{Na}=\dfrac{2,3}{23}=0,1\left(mol\right)\\ 2Na+2H_2O\rightarrow2NaOH+H_2\\ n_{H_2}=\dfrac{0,1}{2}=0,05\left(mol\right);n_{NaOH}=n_{Na}=0,1\left(mol\right)\\ a,V=V_{H_2\left(đktc\right)}=0,05.22,4=1,12\left(l\right)\\ b,m_{ddNaOH}=m_{Na}+m_{H_2O}-m_{H_2}=2,3+200-0,05.2=202,2\left(g\right)\\ C\%_{ddNaOH}=\dfrac{40.0,1}{202,2}.100\approx1,978\%\\ c,NaOH-Tính.bazo\Rightarrow Quỳ.tím.hoá.xanh\)
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn x (g) hỗn hợp: NaI và NaBr vào nước thu được dung dịch X. Cho Br2 dư vào X được dung dịch Y. Cô cạn Y thu được y (g) chất rắn khan. Tiếp tục hòa tan y (g) chất rắn khan trên vào nước thu được dung dịch Z. Cho Cl2 dư vào Z thu được dung dịch T. Cô cạn T được z (g) chất rắn khan. Biết các phản ứng xảy ra hoàn toàn và 2y x + z. Phần trăm khối lượng NaBr trong hỗn hợp đầu bằng: A. 7,3% B. 4,5% C. 3,7% D. 6,7%
Đọc tiếp
Hòa tan hoàn toàn x (g) hỗn hợp: NaI và NaBr vào nước thu được dung dịch X. Cho Br2 dư vào X được dung dịch Y. Cô cạn Y thu được y (g) chất rắn khan. Tiếp tục hòa tan y (g) chất rắn khan trên vào nước thu được dung dịch Z. Cho Cl2 dư vào Z thu được dung dịch T. Cô cạn T được z (g) chất rắn khan. Biết các phản ứng xảy ra hoàn toàn và 2y = x + z. Phần trăm khối lượng NaBr trong hỗn hợp đầu bằng:
A. 7,3%
B. 4,5%
C. 3,7%
D. 6,7%
Hòa tan hoàn toàn 25,4(g) FeCl2 vào 200(ml) nước. Tính nồng độ mol của dung dịch thu được
\(n_{FeCl_2}=\dfrac{25,4}{127}=0,2\left(mol\right)\\ V_{dd}=200ml=0,2l\\ \rightarrow C_{M\left(FeCl_2\right)}=\dfrac{0,2}{0,2}=1M\)
Đúng 2
Bình luận (0)
1. Hòa tan hoàn toàn 16,2(g) kẽm oxit trong 196(g) dung dịch H2SO4 12% sau phản ứng thu được dung dịch X. Tính C% các chất có trong dung dịch X?2. Hòa tan hoàn toàn 16(g) CuO trong 245(g) dung dịch H2SO4 12% sáu phản ứng thu được dung dịch A?3. Hòa tan 16(g) NaOH(rắn) vào nước được 200ml dung dịch NaOH có nồng độ a(M).a) Tìm a?b) Phải thêm vào dung dịch trên bao nhiêu ml nước để thu được dung dịch NaOH 0,5(M)
Đọc tiếp
1. Hòa tan hoàn toàn 16,2(g) kẽm oxit trong 196(g) dung dịch H2SO4 12% sau phản ứng thu được dung dịch X. Tính C% các chất có trong dung dịch X?
2. Hòa tan hoàn toàn 16(g) CuO trong 245(g) dung dịch H2SO4 12% sáu phản ứng thu được dung dịch A?
3. Hòa tan 16(g) NaOH(rắn) vào nước được 200ml dung dịch NaOH có nồng độ a(M).
a) Tìm a?
b) Phải thêm vào dung dịch trên bao nhiêu ml nước để thu được dung dịch NaOH 0,5(M)
Hòa tan hoàn toàn 24 gam SO3 vào nước, thu được dung dịch X có nồng độ 20% (loãng, khối lượng riêng là 1,14 g/ml).
a) Tính thể tích dung dịch X thu được.
b) Hòa tan m gam Fe vào dung dịch X ở trên, phản ứng xảy ra vừa đủ, sau phản ứng thu được dung dịch T và V lít khí (ở 25 độ C và 1 bar).
- Tính các giá trị của m và V.
- Tính nồng độ phần trăm của dung dịch T.
a) PTHH: \(SO_3+H_2O\rightarrow H_2SO_4\)
Ta có: \(n_{SO_3}=\dfrac{24}{80}=0,3\left(mol\right)=n_{H_2SO_4}\) \(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,3\cdot98}{20\%}=147\left(g\right)\)
\(\Rightarrow V_{ddH_2SO_4}=\dfrac{147}{1,14}\approx128,95\left(ml\right)\)
b) PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Theo PTHH: \(n_{Fe}=n_{H_2SO_4}=n_{H_2}=0,3\left(mol\right)=n_{FeSO_4}\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,3\cdot56=16,8\left(g\right)\\V_{H_2}=0,3\cdot24,76=7,428\left(l\right)\\m_{FeSO_4}=0,3\cdot152=45,6\left(g\right)\\m_{H_2}=0,3\cdot2=0,6\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd}=m_{Fe}+m_{ddH_2SO_4}-m_{H_2}=163,2\left(g\right)\)
\(\Rightarrow C\%_{FeSO_4}=\dfrac{45,6}{163,2}\cdot100\%\approx27,94\%\)
Đúng 1
Bình luận (0)
a. Hòa tan 3,1 gam Na2O vào 50 gam nước. Tính C% của dung dịch thu được? b. Hòa tan hoàn toàn 4,6 gam Na vào 95,6 gam nước. Tính C% của dung dịch thu được ?
Đọc tiếp
a. Hòa tan 3,1 gam Na2O vào 50 gam nước. Tính C% của dung dịch thu được?
b. Hòa tan hoàn toàn 4,6 gam Na vào 95,6 gam nước. Tính C% của dung dịch thu được ?
a, \(Na_2O+H_2O\rightarrow2NaOH\)
Ta có: \(n_{Na_2O}=\dfrac{3,1}{62}=0,05\left(mol\right)\)
Theo PT: \(n_{NaOH}=2n_{Na_2O}=0,1\left(mol\right)\)
m dd sau pư = 3,1 + 50 = 53,1 (g)
\(\Rightarrow C\%_{NaOH}=\dfrac{0,1.40}{53,1}.100\%\approx7,53\%\)
b, \(2Na+2H_2O\rightarrow2NaOH+H_2\)
Ta có: \(n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{NaOH}=n_{Na}=0,2\left(mol\right)\\n_{H_2}=\dfrac{1}{2}n_{Na}=0,1\left(mol\right)\end{matrix}\right.\)
Ta có: m dd sau pư = 4,6 + 95,6 - 0,1.2 = 100 (g)
\(\Rightarrow C\%_{NaOH}=\dfrac{0,2.40}{100}.100\%=8\%\)
Đúng 2
Bình luận (0)