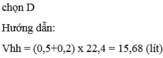Tính thể tích ở (điều kiện chuẩn) của hổn hợp khí gồm 22g CO2 và 16g O2

Những câu hỏi liên quan
có một hỗn hợp khí gồm: 0,25 mol khí O2, 0,1 mol khí N2, 0,45 khí CO2 ( biết các khí điều ở điều kiện tiêu chuẩn). hãy tính thể tích của hỗn hợp khí trên
\(V_{O_2}=0,25.22,4=5,6\left(l\right)\)
\(V_{N_2}=0,1.22,4=2,24\left(l\right)\)
\(V_{CO_2}=0,45.22,4=10,08\left(l\right)\)
\(V_{hh}=5,6+2,24+10,08=17,92\left(l\right)\)
Đúng 0
Bình luận (0)
$V_{hh}=22,4(0,25+0,1+0,45)=17,92(lít)$
Đúng 0
Bình luận (0)
Thể tích hỗn hợp khí gồm 0,5 mol C O 2 và 0,2 mol O 2 ở điều kiện tiêu chuẩn là:
A. 11,2 lít
B. 22,4 lít
C. 4,48 lít
D. 15,68 lít
1.tính số mol có trong 6,72 lít khí oxi ở điều kiện tiêu chuẩn?
2.tính thể tích của hỗn hợp khí gồm 4,4 gam CO2 và 3,2 gam O2?
1. \(n_{O_2}=\frac{V}{22,4}=\frac{6,72}{22,4}=0,3\left(mol\right)\)
2.
\(n_{CO_2}=\frac{m}{M}=\frac{4,4}{44}=0,1\left(mol\right)\)
\(n_{O_2}=\frac{m}{M}=\frac{3,2}{32}=0,1\left(mol\right)\)
\(V_{HC}=n.22,4=\left(0,1+0,1\right).22,4=4,48\left(l\right)\)
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Bài 4: Cho 5,6 lit hỗn hợp khí X gồm NO, N2 ở điều kiện tiêu chuẩn (đktc). Tỉ khối của X so với O2 (dX/O2) bằng 0,9. Tính a. Thể tích mỗi khí trong X ở điều kiện tiêu chuẩn (đktc). b. Thành phần % theo thể tích mỗi khí trong X c. Thành phần % theo khối lượng mỗi khí trong X
a. Ta có: \(n_X=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Gọi x, y lần lượt là số mol của NO và N2
Ta có: \(\overline{M_X}=\dfrac{30x+28y}{x+y}\left(g\right)\)
Mà \(d_{\dfrac{X}{O_2}}=\dfrac{\overline{M_X}}{M_{O_2}}=\dfrac{\overline{M_X}}{32}=0,9\left(lần\right)\)
=> \(\overline{M_X}=28,8\left(g\right)\)
=> \(\dfrac{30x+28y}{x+y}=28,8\left(g\right)\)
<=> \(1,2x-0,8y=0\) (*)
Theo đề, ta có: x + y = 0,25 (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}1,2x-0,8y=0\\x+y=0,25\end{matrix}\right.\)
=> x = 0,1, y = 0,15
=> \(V_{NO}=0,1.22,4=2,24\left(lít\right);V_{N_2}=0,15.22,4=3,36\left(lít\right)\)
b.
\(\%_{V_{NO}}=\dfrac{2,24}{2,24+3,36}.100\%=40\%\)
\(\%_{V_{N_2}}=100\%-40\%=60\%\)
c. Ta có: \(m_{NO}=0,1.30=3\left(g\right)\)
\(m_{N_2}=0,15.28=4,2\left(g\right)\)
=> \(\%_{m_{NO}}=\dfrac{3}{3+4,2}.100\%=41,7\%\)
\(\%_{m_{N_2}}=100\%-41,7\%=58,3\%\)
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn m gam hỗn hợp X gồm 3 amin đồng đẳng bằng một lượng không khí vừa đủ, thu được 5,376 lít
CO
2
, 7,56 gam
H
2
O
và 41,664 lít
N
2
(các thể tích khí đo được ở điều kiện tiêu chuẩn,
O
2
chiếm 20% thể tích không khí,
N
2...
Đọc tiếp
Đốt cháy hoàn toàn m gam hỗn hợp X gồm 3 amin đồng đẳng bằng một lượng không khí vừa đủ, thu được 5,376 lít CO 2 , 7,56 gam H 2 O và 41,664 lít N 2 (các thể tích khí đo được ở điều kiện tiêu chuẩn, O 2 chiếm 20% thể tích không khí, N 2 chiếm 80% thể tích không khí). Giá trị của m là:
A. 10,80 gam
B. 4,05 gam
C. 5,40 gam
D. 8,10gam
Cho 5,6 lit hỗn hợp khí X gồm NO, N2 ở điều kiện tiêu chuẩn (đktc). Tỉ khối của X so với
O2 (dX/O2) bằng 0,9. Tính
a. Thể tích mỗi khí trong X ở điều kiện tiêu chuẩn (đktc).
b. Thành phần % theo thể tích mỗi khí trong X
c. Thành phần % theo khối lượng mỗi khí trong X
a, Vno =2,24l Vn2 = 3,36l
b, %Vno=40%. %Vn2=60%
c, %mno= 41,67%. %mn2 = 58,33%
Đúng 0
Bình luận (0)
Ai bt trả lời giúp vs mai mik thi r
Câu 1 : Đốt cháy 3,6gam cacbon trong không khí theo sơ đồ sau : C + O2 - > CO2 a ) Tính thể tích khí cacbon đoxit ( CO ) ) sinh ra ở điều kiện tiêu chuẩn . b ) Tính thể tích không khí cần dùng ở điều kiện tiêu chuẩn . Biết trong không khí oxi chiếm 1/5 về thể tích
Xem chi tiết
C+O2to-->CO2
0,3--0,3--0,3
nC = 3,6 / 12 = 0,3 (mol)
=> VCO2(đktc) = 0,3 x 22,4 =6,72lít
=>Vkk=6,72\5=33,6l
Đúng 2
Bình luận (2)
PTHH: \(C+O_2\underrightarrow{t^o}CO_2\)
a) Ta có: \(n_C=\dfrac{3,6}{12}=0,3\left(mol\right)=n_{CO_2}\)
\(\Rightarrow V_{CO_2}=0,3\cdot22,4=6,72\left(l\right)\)
b) Theo PTHH: \(n_{O_2}=n_C=0,3mol\)
\(\Rightarrow V_{O_2}=6,72\left(l\right)\) \(\Rightarrow V_{kk}=6,72\cdot5=33,6\left(l\right)\)
Đúng 2
Bình luận (0)
a)Hãy tính số mol và thể tích của hỗn hợp khí gồm: 7,1 g Cl2; 8,8g CO2 và 4,6 g NO2.
b) Tính số mol hỗn hợp gồm 16g O2 và 14g N2
c) Tính số mol và thể tích ở đktc của: 1,5.10^23 p tử N2; 9.10^23 phân tử CO2
Tks ạk
ta có: nCl2=\(\frac{7,1}{71}=0,1mol\)
\(V_{Cl2}=0,1.22,4=2,24\left(l\right)\)
\(n_{CO2}=\frac{8,8}{44}=0,2\left(mol\right)\)
\(V_{CO2}=0,2.22,4=4,48\left(l\right)\)
\(n_{NO2}=\frac{4,6}{46}=0,1\left(mol\right)\)
\(V_{NO2}=0,1.22,4=2,24\left(l\right)\)
\(n_{h^2}=0,1+0,2+0,1=0,4\left(mol\right)\)
\(V_{h^2}=2,24+2,24+4,48=8,96\left(l\right)\)
b) ta có \(n_{O2}=\frac{16}{32}=0,5\left(mol\right)\)
\(n_{N2}=\frac{14}{28}=0,5\left(mol\right)\)
\(\Leftrightarrow n_{h^2}=0,5+0,5=1\left(mol\right)\)
c) vì \(S=n.6.10^{23}\Rightarrow n=\frac{S}{6.10^{23}}\)
\(n_{N2}=\frac{1,5.10^{23}}{6.10^{23}}=0,25\left(mol\right)\)
\(V_{N2}=0,25.22,4=5,6\left(l\right)\)
\(n_{CO2}=\frac{9.10^{23}}{6.10^{23}}=1,5\left(mol\right)\)
\(V_{CO2}=1,5.22,4=33,6\left(l\right)\)
chúc bạn học tốt like mình nha![]()
Đúng 0
Bình luận (0)
đốt cháy 10,35 g hỗn hợp X gồm Mg và Al trong khí oxi dư thấy có 5,88 l O2 phản ứng thể tích khí đo ở điều kiện tiêu chuẩn . Tính khối lượng mỗi chất có trong hỗn hợp X
Gọi $n_{Mg} = a(mol) ; n_{Al} = b(mol) \Rightarrow 24a + 27b = 10,35(1)$
$2Mg + O_2 \xrightarrow{t^o} 2MgO$
$4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3$
$n_{O_2} = \dfrac{1}{2}a + \dfrac{3}{4}b = \dfrac{5,88}{22,4} = 0,2625(2)$
Từ (1)(2) suy ra a = 0,15 ; b = 0,25
$m_{Mg} = 0,15.24 = 3,6(gam)$
$m_{Al} = 0,25.27 = 6,75(gam)$
Đúng 2
Bình luận (0)