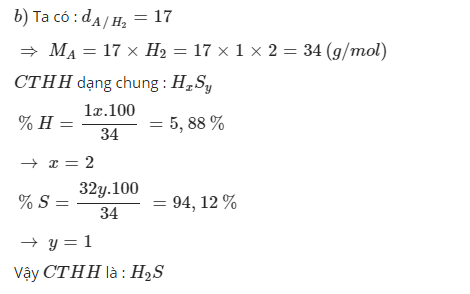tìm công thức hợp chất kết hợp chất nặng hơn khí hidro 17 lần có 5,88% H,94,12%S

Những câu hỏi liên quan
a, Hợp chất A được tạo bởi nguyên tố lưu huỳnh và nguyên tố oxi. Tỉ khối của A so với Hidro là 32. Tìm công thức hóa học của A biết trong A, lưu huỳnh chiếm 50%.
b, Chất khí A có thành phần nguyên tố là: 5,88%H; 94,12% S. Khí A nặng hơn khí hidro 17 lần. Công thức hóa học của hợp chất đó là ?
a) MA = 32.2 = 64(g/mol)
\(m_S=\dfrac{64.50}{100}=32\left(g\right)=>n_S=\dfrac{32}{32}=1\left(mol\right)\)
\(m_O=64-32=32\left(g\right)=>n_O=\dfrac{32}{16}=2\left(mol\right)\)
=> CTHH: SO2
b) MA = 2.17 = 34 (g/mol)
\(m_H=\dfrac{34.5,88}{100}=2\left(g\right)=>n_H=\dfrac{2}{1}=2\left(mol\right)\)
\(m_S=34-2=32\left(g\right)=>n_S=\dfrac{32}{32}=1\left(mol\right)\)
=> CTHH: H2S
Đúng 3
Bình luận (0)
hỹ tìm công thức hóa học của khí A .Biết rằng
khí A nặng hơn khs hidro là 17 lần
thành phần theo khối lượng của khí A là 5,88%H và 94,12% S
\(M_A=17\cdot2=34\left(\dfrac{g}{mol}\right)\)
\(CT:H_xS_y\)
\(\%H=\dfrac{x}{34}\cdot100\%=5.88\%\)
\(\Rightarrow x=2\)
\(\%S=\dfrac{32y}{34}\cdot100\%=94.12\%\)
\(\Rightarrow y=1\)
\(CTHH:H_2S\)
Đúng 3
Bình luận (0)
\(M_A=17.M_{H_2}=34\left(đvC\right)\\ GọiCTcủakhíAlàH_xS\\ Tacó:\%H=\dfrac{x}{34}.100=5,88\%\\ \Rightarrow x=2\\ VậyCTHHcủaA:H_2S\)
Đúng 0
Bình luận (0)
Một hợp chất khí X có thành phần trăm theo khối lượng là: 94,12%S và 5,88%H. Hãy lập công thức hóa học của hợp chất, biết tỉ khối của khí X đối với hidro là 17.
Giúp mình với ạ mình xin mọi người
MX = 17.2 = 34 (g/mol)
\(m_S=\dfrac{94,12.34}{100}=32\left(g\right)=>n_S=\dfrac{32}{32}=1\left(mol\right)\)
\(m_H=\dfrac{5,88.34}{100}=2\left(g\right)=>n_H=\dfrac{2}{1}=2\left(mol\right)\)
=> CTHH: H2S
Đúng 1
Bình luận (2)
Hãy tìm công thức hóa học của khí A.
- Khí A nặng hơn khí hiđro 17 lần.
- Thành phần theo khối lượng của khí A là 5,88% H và 94,12% S.
Khối lượng mol của khí A : dA/H2 = 17 ⇒ MA = 17.2 = 34 (g)
Khối lượng mỗi nguyên tố có trong 1 mol khí A:
 mS = 34 – 2 = 32 (g)
mS = 34 – 2 = 32 (g)
Số mol nguyên tử mỗi nguyên tố trong 1 mol khí A có:
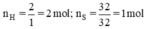
Vậy trong 1 mol phân tử chất A có : 2 nguyên tử H và 1 nguyên tử S
⇒ CTHH của khí A là H2S
Đúng 0
Bình luận (0)
Xác định công thức của các chất sau
a)E có 24,68%K ;34,81%Mn ;40,51%O .E nặng hơn NaNO3 1,86 lần .
b)F chứa 5,88% về khối lượng là H còn lại là của S. F nặng hơn khí hidro 17 lần
câu 92: X là hợp chất với khí hiđro của phi kim S,trong hợp chất này S chiếm 94,12%;H chiếm 5,88%.biết d/H217.X là công thức hoá học nào sau đây:A.HS B.H4S C.H6S2 D.H2SCâu 93:có những chất rắn sau: CaO,P2O5,MgO,NA2SO4. dùng những thuốc thử nào có thể phân biệt được các chất trên:A.dùng dung địch NaOHB.dùng axit H2SO4C.dùng axit và giấy quì tímD.dùng H2O và giấy quì tímCâu 94: khi phân tích 1 mẫu quặng sắt Fe2O3 người ta thấy có 2,8g Fe. khối lượng Fe2O3...
Đọc tiếp
câu 92: X là hợp chất với khí hiđro của phi kim S,trong hợp chất này S chiếm 94,12%;H chiếm 5,88%.biết d/H2=17.X là công thức hoá học nào sau đây:
A.HS B.H4S C.H6S2 D.H2S
Câu 93:có những chất rắn sau: CaO,P2O5,MgO,NA2SO4. dùng những thuốc thử nào có thể phân biệt được các chất trên:
A.dùng dung địch NaOH
B.dùng axit H2SO4
C.dùng axit và giấy quì tím
D.dùng H2O và giấy quì tím
Câu 94: khi phân tích 1 mẫu quặng sắt Fe2O3 người ta thấy có 2,8g Fe. khối lượng Fe2O3 có trong mẫu quặng trên là :
A. 4g B. 6g C. 5g D. 12g
Câu 93 :D
Cho nước vào mẫu thử :
- mẫu thử không tan là MgO
$P_2O_5 + 3H_2O \to 2H_3PO_4$
$CaO + H_2O \to Ca(OH)_2$
Cho giấy quỳ tím vào dung dịch trên :
- mẫu thử hóa đỏ là $P_2O_5$
- mẫu thử hóa xanh là $CaO$
- mẫu thử không đổi màu là $Na_2SO_4$
Câu 92 : D
Đúng 1
Bình luận (0)
Câu 94 :
$n_{Fe} = \dfrac{2,8}{56} = 0,05(mol)$
Bảo toàn nguyên tố với Fe :
$n_{Fe_2O_3} = \dfrac{1}{2}n_{Fe} = 0,025(mol)$
$m_{Fe_2O_3} = 0,025.160 = 4(gam)$
Đáp án A
Đúng 1
Bình luận (0)
Hãy tìm công thức hóa học của khí A, biết rằng:
- Khí A nặng hơn khí hydrogen là 17 lần.
- Thành phần phần trăm theo khối lượng của khí A là 5,88% H và 94,12% S.
Ta có \(M_A=2.17=34(g/mol)\)
Trong 1 mol A: \(\left\{{}\begin{matrix}n_H=\dfrac{34.5,88\%}{1}=2\left(mol\right)\\n_S=\dfrac{34.94,12\%}{32}=1\left(mol\right)\end{matrix}\right.\)
Vậy CTHH A là \(H_2S\)
Đúng 4
Bình luận (1)
bài 1: tìm CTHH của khí A, biết rằng:
_ khí A nặng hơn khí hidro là 17 lần
_ thành phàn theo khói lượng của khí A là : 5,88% H và 94,12% S
bài 2 : Tìm CTHH của hợp chất B dễ bay hơi, có thành phần phân yuwr là 23,8% C , 5,9% H và 70,3 % Ck, biết phân tử khối của B gấp 2,805 lần phân tử khối của nước .
Mọi người giúp mình nha.. mình gấp lắm
Gọi CTHH của A là: HxSy
Vì khí A nặng hơn Khí hiđrô 17 lần nên PTK của khí A là: 2 . 17 = 34 (đvC)
x:y = \(\frac{\%H}{M_H}=\frac{\%S}{M_S}=\frac{5,88\%}{1}=\frac{94,12\%}{32}=2:1\)
=> CTHH là: ( H2S)n = 34
<=> 34n = 34 => n= 1
CTHH của A là H2S
Đúng 1
Bình luận (0)
Bài 1 :
Ta có: = 17 => MA = 17 . 2 = 34
Khối lượng của mỗi nguyên tố có trong 1 mol khí A
=> mH = = 2 (g) => mS =
= 32 (g)
hoặc mS = 34 - 2 = 32 (g)
Số mol nguyên tử của mỗi nguyên tố trong 1 mol khí A:
nH = = 2 mol nS =
= 1 mol
Suy ra trong 1 phân tử hợp chất A có 2 nguyên tử H và 1 nguyên tử S. Do đó công thức hóa học của khí A là H2S
Đúng 1
Bình luận (1)
Bài 1 : Nặng hơn khí Hiđrô là 17 lần => M(khí) = 17 x 2 = 34 (đvc).
Gọi khí là H(a)S(b)
Thành phần khối lượng của khí:
0,0588 x 1 x a + 0,9412 x b x 32 = 34.
Lập cái bảng xét giá trị của a và b, em được a=2, b=1.
Khí đó là H2S
Đúng 0
Bình luận (1)
Tìm công thức hóa học của khí A. Biết rằng: khí A nặng hơn H2 17 lần, thành phần theo khối lượng khí A 5,88% H và 94,12% S ?
A. H2S B. HS
C. H2S2 D. H4S
Tìm công thức hóa học của khí A. Biết rằng: khí A nặng hơn H2 17 lần, thành phần theo khối lượng khí A 5,88% H và 94,12% S ?
A. H2S B. HS
C. H2S2 D. H4S
Đúng 0
Bình luận (0)