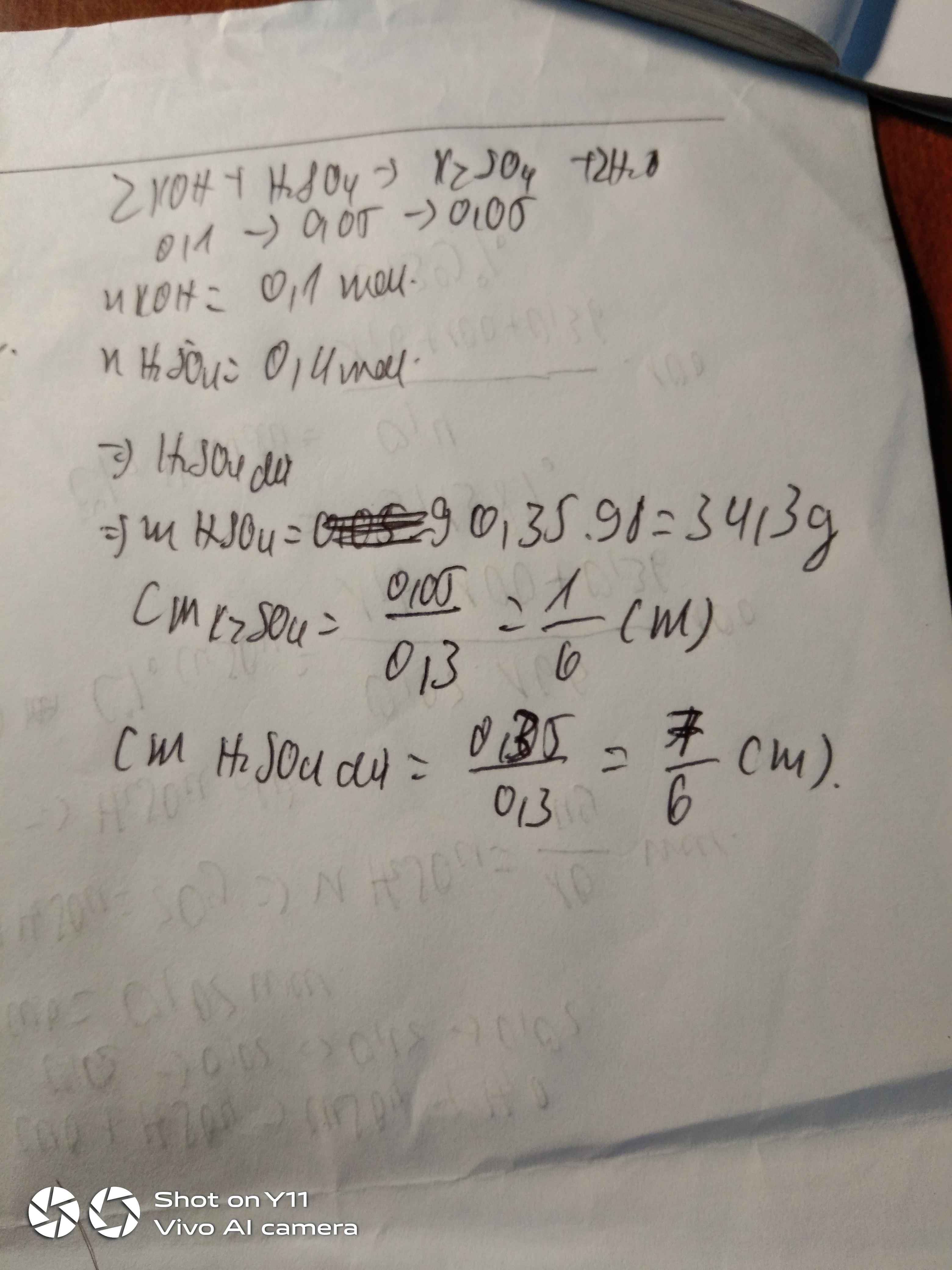Trộn lẫn 100ml dd Koh 1M và H2So4 0.625M thu đc dd Y a) tính nồng độ các ion trong dd b) tính ph sau phản ứng

Những câu hỏi liên quan
Trộn 100ml dd ba(oh)2 0.3M với 100ml dd h2so4 0.05M thu được dd X và kết tủa Y a/ tính ph của dd Y b/ tính kl kết tủa Y c/ tính nồng độ các ion còn lại trong dd X
Trộn lẫn 100ml dd K2CO3 0,5M với 100ml dd CaCl2 0,1M.
a. Tính khối lượng kết tủa thu được.
b. Tính CM các ion trong dd sau phản ứng
\(n_{K_2CO_3}=0.1\cdot0.5=0.05\left(mol\right)\)
\(n_{CaCl_2}=0.1\cdot0.1=0.01\left(mol\right)\)
\(K_2CO_3+CaCl_2\rightarrow CaCO_3+2KCl\)
Lập tỉ lệ :
\(\dfrac{0.05}{1}>\dfrac{0.01}{1}\) \(\Rightarrow K_2CO_3dư\)
\(n_{CaCO_3}=n_{CaCl_2}=0.01\left(mol\right)\)
\(m=0.01\cdot100=1\left(g\right)\)
\(b.\)
Các chất có trong dung dịch :
\(K_2CO_3\left(dư\right):0.04\left(mol\right),KCl:0.02\left(mol\right)\)
\(V=0.1+0.1=0.2\left(l\right)\)
\(\left[K^+\right]=\dfrac{0.04\cdot2+0.02}{0.2}=0.5\left(M\right)\)
\(\left[CO_3^{2-}\right]=\dfrac{0.04}{0.2}=0.2\left(M\right)\)
\(\left[Cl^-\right]=\dfrac{0.02}{0.2}=0.1\left(M\right)\)
Đúng 1
Bình luận (0)
cho 100ml dd KOH 1M phản ứng với 200ml dd H2SO4 nồng độ 2M a) hỏi sau phản ứng chất nào dư, dư bao nhiêu b) tính nồng độ mol của dd sau phản ứng
C là dung dịch h2so4 nồng độ x mol/l , D là dd koh nồng độ y mol/l . trộn 200ml dd C với 300ml dd D thu được 500ml dd E. để trung hòa 100ml dd E cần dùng 40ml h2so4 1m. mặt khác trộn 300ml dd C với 200ml dd D thu đươc 500ml dd F . xác định x,y biết rằng 100ml dd F phản ứng vừa đủ với 2.04g Al2o3
1. Trộn 400ml dd KOH 1,5M với 600ml dd KOH 1,2M. Tính nồng độ mol và nồng động phần trăm của của dd sau khi trộn dung dịch sau trộn có khối lượng riêng bằng 1,12g/ml?2.a/ Trộn lẫn 100 gam dd H2SO4 10% với 200 gam dd H2SO4 C% thu được dd H2SO4 30%. Tính C%b/ Trong Cho m gam NaCl vào nước được 200 gam dung dịch NaCl 15%. Tính nồng độ mol của dung dich NaCl. Biết dung dich NaCl có D 1,1g/ml
Đọc tiếp
1. Trộn 400ml dd KOH 1,5M với 600ml dd KOH 1,2M. Tính nồng độ mol và nồng động phần trăm của của dd sau khi trộn dung dịch sau trộn có khối lượng riêng bằng 1,12g/ml?
2.
a/ Trộn lẫn 100 gam dd H2SO4 10% với 200 gam dd H2SO4 C% thu được dd H2SO4 30%. Tính C%
b/ Trong Cho m gam NaCl vào nước được 200 gam dung dịch NaCl 15%. Tính nồng độ mol của dung dich NaCl. Biết dung dich NaCl có D= 1,1g/ml
2
b
mNaCl=\(\dfrac{200.15}{100}\)=30(g)
nNaCl=\(\dfrac{30}{58,5}\)=0.51(mol)
VddNaCl=\(\dfrac{200}{1,1}\)=181.8(ml)=0.1818(l)
CMNaCl=\(\dfrac{0,51}{0,1818}\)=2.8(M)
Đúng 1
Bình luận (0)
Trộn lẫn 100ml dd KOH 1M với 100ml dd HCl 0,5M thu được dd D .
a/ Tính nồng độ mol/l của ion OH- có trong dd D .
b/ Tính thể tích dd H2SO4 1M đủ để trung hòa hết dd D .
HELP ME !!!!
nOH-= 0.1*1=0.1 mol
nH+=0.5*0.1=0.05 mol
OH- + H+ --> H2O
0.05__0.05
CMOH-=(0.1-0.05)/(0.1+0.1)= 0.25M
nOH-=nH+=0.05 mol
VddH2SO4= 0.05/1=0.05l
Đúng 0
Bình luận (2)
a) Ta có: nOH- = nKOH= 0,1 . 1 = 0,1 (mol)
nH+ = nHCl = 0,1 . 0,5 = 0,05 (mol)
Phương trình ion: OH- + H+ -> H2O
Trước phản ứng: 0,1 0,05
Phản ứng: 0,05 0,05 0,05
Sau phản ứng: 0,05 0 0,05
Do đó: CM (OH-) = \(\frac{0,05}{0,1+0,1}=0,25\)(M)
b) Phương trình ion: OH- + H+ -> H2O
Để trung hoà hết dung dịch D thì \(n_{H^+}=n_{OH^-}=0,05\)(mol)
=> \(V_{H_2SO_4}=\frac{0,05}{1}=0,05\)(l)
Đúng 0
Bình luận (1)
Trộn 200ml dd h2so4 có nồng độ x mol/l (dd c) với 300ml dd koh nồng độ y mol/l (dd d), thu được 500ml dd e làm quỳ tím chuyển màu xanh. Để trung hòa 100ml dd e cần dùng 40ml dd h2so4 1m. Mặt khác trộn 300ml dd c với 200ml dd d thì thu được 500ml dd f. Biết rằng 100ml dd f phản ứng vừa đủ với 1,08g kl Al. Tìm x, y
Giúp mik vs
hòa tan hoàn toàn 6.5gam kẽm trong 100ml đ H2SO4 có pH=0.48. Tính nồng độ các ion và pH dd sau phản ứng ?
Trộn lẫn 100ml dd HCl 0,1M với 300 ml dd NaCl 0,2M. Tính nồng độ ion trong dd sau khi trỗn lẫn (giả sử sau khi trộn lẫn thể tích dd thay đổi không đáng kể)?
\(\left[H^+\right]=\dfrac{0,1.0,1}{0,1+0,3}=0,025M\)
\(\left[Cl^-\right]=\dfrac{0,1.0,1+0,2.0,3}{0,1+0,3}=0,175M\)
\(\left[Na^+\right]=\dfrac{0,2.0,3}{0,1+0,3}=0,15M\)
Đúng 1
Bình luận (0)