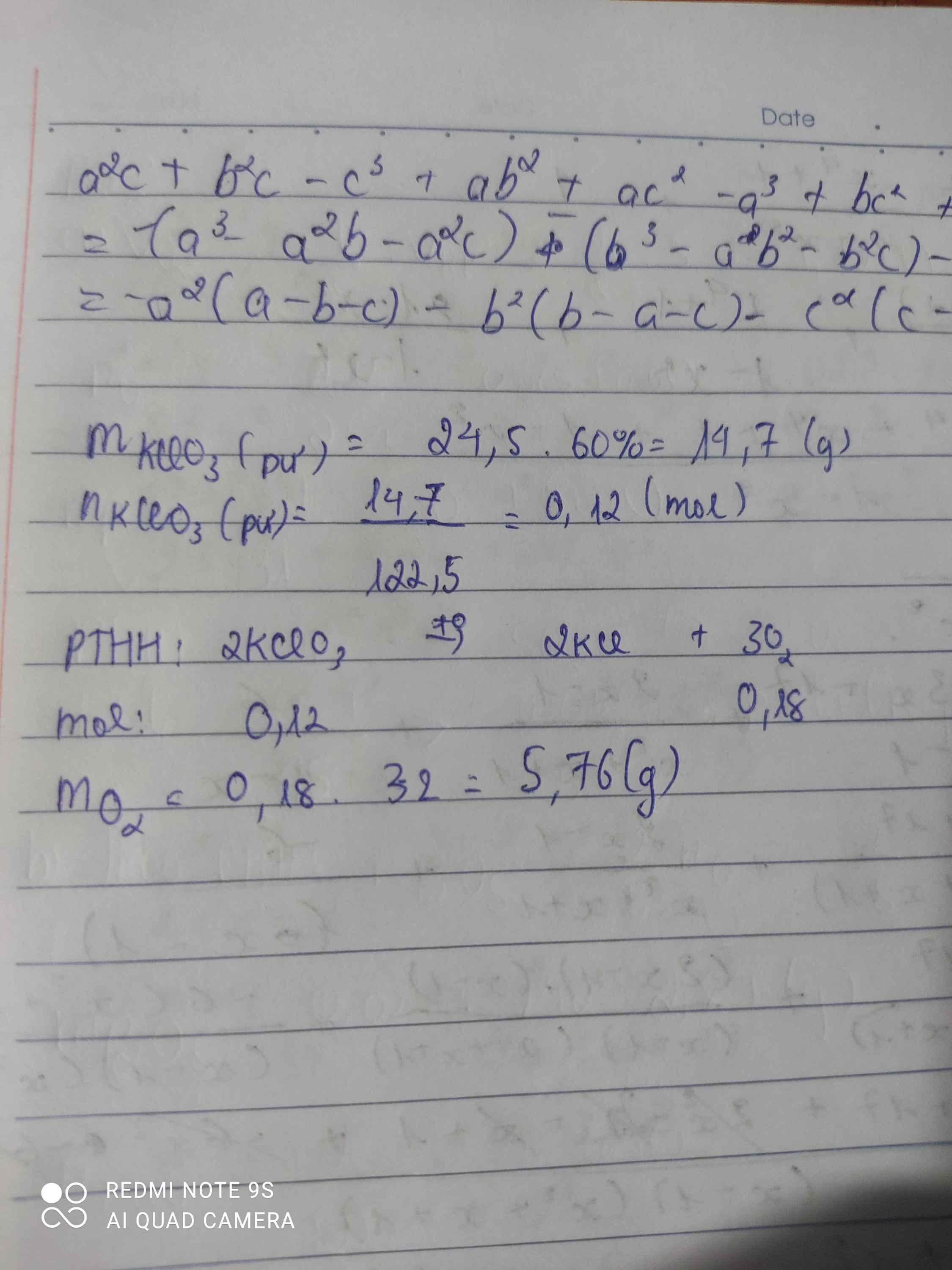Người ta điều chế khí oxi bằng cách nung 19,6 gam KClO3.Tính thể tích khí oxi thu đc , biết hiệu suất p/ứ đạt 80%.

Những câu hỏi liên quan
Để điều chế khí oxi trong phòng thí nghiệm, người ta nung nóng 55,125 gam kali clorat KClO3 ở nhiệt độ cao với chất
xúc tác MnO2. Tính thể tích khí oxi thu được ở đktc, biết hiệu suất của phản ứng đạt 85%.
\(n_{KClO_3\left(bd\right)}=\dfrac{55,125}{122,5}=0,45\left(mol\right)\)
=> \(n_{KClO_3\left(pư\right)}=\dfrac{0,45.85}{100}=0,3825\left(mol\right)\)
PTHH: 2KClO3 --to,MnO2--> 2KCl + 3O2
0,3825------------------->0,57375
=> \(V_{O_2}=0,57375.22,4=12,852\left(l\right)\)
Đúng 4
Bình luận (0)
2KClO3-to>2KCl+3O2
0,45---------------------0,675 mol
n KClO3=\(\dfrac{55,125}{122,5}\)=0,45 mol
=>H=85%
=>VO2=0,675.22,4.\(\dfrac{85}{100}\)=12,852l
Đúng 3
Bình luận (1)
Trg phòng thí nghiệm. Khi điều chế khí oxi,người ta dùng 12,25g KCLO3. Hãy tính thể tích khí oxi thu được ở đktc. Biết hiệu suất pư dư đạt 80%
PTHH :
\(2KClO_3\overrightarrow{t^o}2KCl+3O_2\uparrow\)
\(n_{KClO_3}=\dfrac{12,25}{122,5}=0,1\left(mol\right)\)
Theo PTHH :
\(n_{O_2}=\dfrac{3}{2}n_{KClO_3}=0,15\left(mol\right)\)
\(V_{O_2}=0,15.22,4=3,36\left(l\right)\)
\(V_{O_{2thucte}}=3,36.80\%=2,688\left(l\right)\)
Đúng 2
Bình luận (2)
Còn có thể điều chế khí oxi bằng cách nung nóng kali clorat
K
C
l
O
3
(chất rắn màu trắng). Khi đun nóng 24,5g
K
C
l
O
3
, chất rắn còn lại trong ống nghiệm có khối lượng là 13,45g. Tính khối lượng khí oxi thu được, biết hiệu suất của phản ứng phân hủy là 80%.
Đọc tiếp
Còn có thể điều chế khí oxi bằng cách nung nóng kali clorat K C l O 3 (chất rắn màu trắng). Khi đun nóng 24,5g K C l O 3 , chất rắn còn lại trong ống nghiệm có khối lượng là 13,45g. Tính khối lượng khí oxi thu được, biết hiệu suất của phản ứng phân hủy là 80%.
Theo định luật bảo toàn khối lượng, ta có khối lượng khí oxi thu được là:
m O 2 = 24,5 – 13,45 = 11,05(g)
Khối lượng thực tế oxi thu được: m O 2 = (11,05 x 80)/100 = 8,84 (g)
Đúng 0
Bình luận (0)
điều chế oxi bằng cách nung 24,5g KCLO3 tính lượng oxi thu được ,biết hiệu suất phản ứng chỉ đạt 60%
Số mol KClO3 là:
\(n_{KClO_3}=\dfrac{24,5}{122,5}=0,2\left(mol\right)\)
PTHH
\(2KClO_3\rightarrow2KCl+3O_2\)
0,2 mol.....................0,3mol
lượng oxi thu dc trên lý thuyết là:
\(m_{O_2}=0,3.32=9.6\left(g\right)\)
Lượng oxi thu dc thực tế là:
\(m_{O_2thucte}=9,6.60\%=5,76\left(g\right)\)
Đúng 0
Bình luận (0)
Ta có \(n_{KClO_3}=\dfrac{24,5}{122,5}=0,2\left(mol\right)\)
PTHH : 2KClO3 \(\underrightarrow{t^0}\)2KCl + 3O2
0,2 0,3 (mol)
Mà H = 60 %
\(\Rightarrow n_{O_2}=0,3.60\%=0,18\left(mol\right)\)
\(=>m_{O_2}=0,18.32=5,76\left(g\right)\)
Đúng 0
Bình luận (1)
điều chế oxi bằng cách nung 24,5g KCLO3 tính lượng oxi thu được ,biết hiệu suất phản ứng chỉ đạt 60% làm bằng 2 cách
C1
\(m_{KClO_3\left(pư\right)}=\dfrac{24,5.60}{100}=14,7\left(g\right)\)
\(n_{KClO_3\left(pư\right)}=\dfrac{14,7}{122,5}=0,12\left(mol\right)\)
PTHH: 2KClO3 --to--> 2KCl + 3O2
0,12--------->0,12--->0,18
=> \(m_{O_2}=0,18.32=5,76\left(g\right)\)
C2: \(m_{KCl}=0,12.74,5=8,94\left(g\right)\)
Theo ĐLBTKL: \(m_{KClO_3\left(pư\right)}=m_{KCl}+m_{O_2}\)
=> \(m_{O_2}=14,7-8,94=5,76\left(g\right)\)
Đúng 5
Bình luận (0)
ta có
\(n_{KClO_3}=\dfrac{24.5}{122,5}=0,2\left(mol\right)\)
PTHH : \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
0,2 0,3 ( mol)
Mà H = 60 %
\(\Rightarrow n_{O_2}=0,3.60\%=0,18\left(mol\right)\\ \Rightarrow m_{O_2}=0,18.32=5,76\left(g\right)\)
Đúng 0
Bình luận (3)
Để điều chế oxi trong phòng thí nghiệm người ta nung nóng kali clorat
a) Viết phương trình hoá học
b) Tính khối lượng kali clorua và thể tích khí oxi thu được ( ở đktc) khi nung nóng 12,25g KCLO3. Biết hiệu suất là 85%
c) Tính kali clorat cần dùng để thu được 4,032 lít khí oxi ( ở đktc) khi nung nóng. Biết hiệu suất phản ứng là 80%.
Điều chế khí oxi bằng cách nhiệt phân 1mol KClO3 thì thu được 43,2 gam khí oxi và một lượng kali clorua (KCl) . Tính hiệu suất phản ứng ?
\(n_{O_2}=\dfrac{43.2}{32}=1.35\left(mol\right)\)
\(2KClO_3\underrightarrow{^{t^0}}2KCl+3O_2\)
\(0.9...........................1.35\)
\(H\%=\dfrac{0.9}{1}\cdot100\%=90\%\)
Đúng 3
Bình luận (1)
PT: \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
______1_____________1,5 (mol)
⇒ mO2 (lí thuyết) = 1,5.32 = 48 (g)
Mà: mO2 (thực tế) = 43,2 (g)
\(\Rightarrow H\%=\dfrac{43,2}{48}.100\%=90\%\)
Bạn tham khảo nhé!
Đúng 1
Bình luận (1)
\(n_{O_2}\)=\(\dfrac{43,2}{32}=1,35\left(mol\right)\)
PTHH 2KClO3-----to--->2KCl +3O2
=>\(n_{O_2\left(lt\right)}=1.\dfrac{3}{2}=1,5\left(mol\right)\)
=>H%=\(\dfrac{1,35}{1,5}.100\%=90\%\)
Đúng 0
Bình luận (0)
nhiệt phân 49 gam KClO3 . tính thể tích khí oxi thu được ở điều kiện tiêu chuẩn biết hiệu suất phản ứng đạt 90%
nKClO3 = 49/122,5 = 0,4 (mol)
PTHH: 2KClO3 -> (t°, MnO2) 2KCl + 3O2
nO2 (TT) = 0,6 . 90% = 0,54 (mol)
VO2 = 0,54 . 22,4 = 12,096 (l)
Đúng 5
Bình luận (1)
Đốt cháy hoàn toàn m gam nhôm trong oxi dư người ta thu được 30,6 gam nhôm oxit (Al2O3)a) Tìm khối lượng nhôm phản ứng, thể tích oxi, thể tích không khí cần dùng b)Tính khối lượng Kaliclorat (KClO3 )cần dùng để điều chế được lượng oxi dùng cho phản ứng trên? (Hiệu suất phản ứng nung là H100%) c)Tính khối lượng Kaliclorat cần dùng để điều chế được lượng oxi dùng cho phản ứng trên? (Hiệu suất phản ứng nung là H75%) (K39, Cl35,5, Al27, O16)
Đọc tiếp
Đốt cháy hoàn toàn m gam nhôm trong oxi dư người ta thu được 30,6 gam nhôm oxit (Al2O3)
a) Tìm khối lượng nhôm phản ứng, thể tích oxi, thể tích không khí cần dùng
b)Tính khối lượng Kaliclorat (KClO3 )cần dùng để điều chế được lượng oxi dùng cho phản ứng trên? (Hiệu suất phản ứng nung là H=100%)
c)Tính khối lượng Kaliclorat cần dùng để điều chế được lượng oxi dùng cho phản ứng trên? (Hiệu suất phản ứng nung là H=75%) (K=39, Cl=35,5, Al=27, O=16)
a.\(n_{Al_2O_3}=\dfrac{30,6}{102}=0,3mol\)
\(4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\)
0,6 0,45 0,3 ( mol )
\(m_{Al}=0,6.27=16,2g\)
\(V_{O_2}=0,45.22,4=10,08l\)
\(V_{kk}=10,08.5=50,4l\)
b.\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
0,3 0,45 ( mol )
\(m_{KClO_3}=0,3.122,5=36,75g\)
c.\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
0,3 0,45 ( mol )
\(n_{KClO_3}=\dfrac{0,3}{75\%}=0,4mol\)
\(m_{KClO_3}=0,4.122,5=49g\)
Đúng 3
Bình luận (0)