Câu 31. Cho 8,0 gam đồng (II) oxit tác dụng vừa đủ với dung dịch H2SO4 0,5M.
a) Viết phương trình phản ứng xảy ra.
b) Tính khối lượng muối tạo thành sau phản ứng và thể tích của dung dịch H2SO4 phản ứng

Những câu hỏi liên quan
Cho 4g CuO tác dụng vừa đủ với dung dịch H2SO4 loãng 0,5M
a. Viết phương trình hóa học
b. Tính khối lượng muối tạo thành
c. Tính thể tích dung dịch H2SO4 đã dùng
d. Tính nồng độ mol của muối có trong dung dịch sau phản ứng ( coi thể tích dung dịch không đáng kể )
\(n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)\\a, CuO+H_2SO_4\rightarrow CuSO_4+H_2O\\ n_{CuSO_4}=n_{H_2SO_4}=n_{CuO}=0,05\left(MOL\right)\\ b,m_{CuSO_4}=0,05.160=8\left(g\right)\\ c,V_{ddH_2SO_4}=\dfrac{0,05}{0,5}=0,1\left(l\right)\\ d,V_{ddCuSO_4}=V_{ddH_2SO_4}=0,1\left(l\right)\\ C_{MddCuSO_4}=\dfrac{0,05}{0,1}=0,5\left(M\right)\)
Đúng 2
Bình luận (0)
Cho 28 gam sắt tác dụng với lượng dung axit sunfuric (H2SO4) tạo muối sắt (II) sunfat và khí hiđro.
a) Viết phương trình phản ứng xảy ra.
b) Tính khối lượng axit tham gia phản ứng.
c) Tính khối lượng muối thu được sau phản ứng.
d) Cho khí hiđro thu được ở trên qua CuO vừa đủ, nung nóng. Sau khi phản ứng xảy ra hoàn toàn thu được m gam kim loại. Tính m
Ta có: \(n_{Fe}=\dfrac{28}{56}=0,5\left(mol\right)\)
a, PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
______0,5____0,5_____0,5_____0,5 (mol)
b, mH2SO4 = 0,5.98 = 49 (g)
c, mFeSO4 = 0,5.152 = 76 (g)
d, \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
____0,5__0,5 (mol)
⇒ mCu = 0,5.64 = 32 (g)
Bạn tham khảo nhé!
Đúng 1
Bình luận (0)
Câu 15: (3đ) Cho 10,6 gam Na2CO3 tác dụng hoàn toàn với dung dịch H2SO4a/ Viết phương trình phản ứng xảy ra.b/ Tính khối lượng muối tạo thành sau phản ứng.c/ Tính thể tích khí CO2 sinh ra ở đktc.d/ Toàn bộ khí sinh ra được dẫn vào 300ml dung dịch Ca(OH)2 0,5M thì thu được một kết tủa. Tính khối lượng kết tủa này, biết hiệu suất của phản ứng hấp thụ khí đạt 80%.
Đọc tiếp
Câu 15: (3đ) Cho 10,6 gam Na2CO3 tác dụng hoàn toàn với dung dịch H2SO4
a/ Viết phương trình phản ứng xảy ra.
b/ Tính khối lượng muối tạo thành sau phản ứng.
c/ Tính thể tích khí CO2 sinh ra ở đktc.
d/ Toàn bộ khí sinh ra được dẫn vào 300ml dung dịch Ca(OH)2 0,5M thì thu được một kết tủa. Tính khối lượng kết tủa này, biết hiệu suất của phản ứng hấp thụ khí đạt 80%.
Câu 15: (3đ) Cho 10,6 gam Na2CO3 tác dụng hoàn toàn với dung dịch H2SO4a/ Viết phương trình phản ứng xảy ra.b/ Tính khối lượng muối tạo thành sau phản ứng.c/ Tính thể tích khí CO2 sinh ra ở đktc.d/ Toàn bộ khí sinh ra được dẫn vào 300ml dung dịch Ca(OH)2 0,5M thì thu được một kết tủa. Tính khối lượng kết tủa này, biết hiệu suất của phản ứng hấp thụ khí đạt 80%.
Đọc tiếp
Câu 15: (3đ) Cho 10,6 gam Na2CO3 tác dụng hoàn toàn với dung dịch H2SO4
a/ Viết phương trình phản ứng xảy ra.
b/ Tính khối lượng muối tạo thành sau phản ứng.
c/ Tính thể tích khí CO2 sinh ra ở đktc.
d/ Toàn bộ khí sinh ra được dẫn vào 300ml dung dịch Ca(OH)2 0,5M thì thu được một kết tủa. Tính khối lượng kết tủa này, biết hiệu suất của phản ứng hấp thụ khí đạt 80%.
\(a,PTHH:Na_2CO_3+H_2SO_4\rightarrow Na_2SO_4+H_2O+CO_2\uparrow\\ b,n_{Na_2CO_3}=\dfrac{10,6}{106}=0,1\left(mol\right)\\ \Rightarrow n_{Na_2SO_4}=0,1\left(mol\right)\\ \Rightarrow m_{Na_2SO_4}=0,1\cdot142=14,2\left(g\right)\\ c,n_{CO_2}=n_{Na_2CO_3}=0,1\left(mol\right)\\ \Rightarrow V_{CO_2\left(đktc\right)}=0,1\cdot22,4=2,24\left(l\right)\)
\(d,n_{Ca\left(OH\right)_2}=0,5\cdot0,3=0,15\left(mol\right)\\ PTHH:CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\)
Vì \(\dfrac{n_{Ca\left(OH\right)_2}}{1}>\dfrac{n_{CO_2}}{1}\) nên Ca(OH)2 dư, tính theo CO2
\(\Rightarrow n_{CaCO_3}=n_{CO_2}=0,1\left(mol\right)\\ \Rightarrow m_{CaCO_3}=0,1\cdot100\cdot80\%=8\left(g\right)\)
Đúng 3
Bình luận (0)
Câu 1: Cho 32,5g kẽm phản ứng vừa đủ với dung dich axit H2SO4 9%.
a) Viết PTHH xảy ra.
b) Tính thể tích khí hiđrô sinh ra (đktc).
c) Tính khối lượng dung dịch H2SO4 cần dùng.
d) Tính C% của dung dịch muối thu được.
\(a.n_{Zn}=\dfrac{32,5}{65}=0,5\left(mol\right)\\ PTHH:Zn+H_2SO_4\rightarrow ZnSO_4+H_2\\ 0,5..........0,5...........0,5........0,5\left(mol\right)\\ b.V_{H_2\left(đktc\right)}=0,5.22,4=11,2\left(l\right)\\ c.m_{ddH_2SO_4}=\dfrac{0,5.98.100}{9}=\dfrac{4900}{9}\left(g\right)\\ d.C\%_{ddZnSO_4}=\dfrac{0,5.161}{\dfrac{4900}{9}}.100\approx14,786\%\)
Đúng 2
Bình luận (0)
Cho 13g kẽm tác dụng với 200 gam dung dịch axit H2SO4 nồng độ 24,5%.
a. Viết phương trình phản ứng xảy ra?
b. Sau phản ứng chất nào còn dư và dư bao nhiêu gam?
c. Tính khối lượng muối tạo thành và khối lượng hiđro thoát ra?
\(a) Zn + H_2SO_4 \to ZnSO_4 + H_2\\ n_{Zn} = \dfrac{13}{65} = 0,2 < n_{H_2SO_4} = \dfrac{200.24,5\%}{98} = 0,5 \to H_2SO_4\ dư\\ n_{H_2SO_4\ pư} =n_{Zn} = 0,2(mol)\\ \Rightarrow m_{H_2SO_4\ dư} = (0,5 - 0,2).98 = 29,4(gam)\\ c) n_{FeSO_4} = n_{H_2} = n_{Zn} = 0,2(mol)\\ m_{FeSO_4} = 0,2.152 = 30,4(gam)\\ V_{H_2} = 0,2.22,4 = 4,48(lít)\)
Đúng 2
Bình luận (3)
Cho 12 gam hỗn hợp X gồm Fe và FeO tác dụng vừa đủ với dung dịch HCl. Sau phản ứng thu được 3,36 lít khí H2 (đktc).
a. Viết các phương trình phản ứng xảy ra.
b. Tính khối lượng của mỗi chất trong hỗn hợp X và thể tích dung dịch HCl 2M đã dùng.
c. Cho lượng hỗn hợp X nói trên vào dung dịch CuSO4 dư thì sau phản ứng thu được bao nhiêu gam chất rắn.
a)
$Fe + 2HCl \to FeCl_2 + H_2$
$FeO + 2HCl \to FeCl_2 + H_2O$
b)
Theo PTHH : $n_{Fe} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)$
$m_{Fe} = 0,15.56 = 8,4(gam)$
$m_{FeO} = 12 - 8,4 = 3,6(gam)$
$n_{FeO} =0,05(mol)$
Theo PTHH : $n_{HCl} = 2n_{Fe} + 2n_{FeO} = 0,4(mol)$
$V_{dd\ HCl} = \dfrac{0,4}{2} = 0,2(lít)$
c) $Fe + CuSO_4 \to FeSO_4 + Cu$
$n_{Cu} = n_{Fe} = 0,15(mol) \Rightarrow m_{chất\ rắn} = m_{FeO} + m_{Cu}$
$= 3,6 + 0,15.64 = 13,2(gam)$
Đúng 0
Bình luận (0)
Cho 3,64 gam hỗn hợp E gồm một oxit, một hiđroxit và một muối cacbonat trung hòa của một kim loại M có hóa trị II tác dụng vừa đủ với 117,6 gam dung dịch H2SO4 10%. Sau phản ứng, thu được 0,448 lít khí (đktc) và dung dịch muối duy nhất có nồng độ 10,867% (khối lượng riêng là 1,093 gam/ml); nồng độ mol là 0,545M. a) Viết các phương trình phản ứng xảy ra và xác định kim loại M. b) Tính % khối lượng của các chất có trong hỗn hợp E.
Đọc tiếp
Cho 3,64 gam hỗn hợp E gồm một oxit, một hiđroxit và một muối cacbonat trung hòa của một kim loại M có hóa trị II tác dụng vừa đủ với 117,6 gam dung dịch H2SO4 10%. Sau phản ứng, thu được 0,448 lít khí (đktc) và dung dịch muối duy nhất có nồng độ 10,867% (khối lượng riêng là 1,093 gam/ml); nồng độ mol là 0,545M.
a) Viết các phương trình phản ứng xảy ra và xác định kim loại M.
b) Tính % khối lượng của các chất có trong hỗn hợp E.
a) Đặt số mol của MO, M(OH)2, MCO3 tương ứng là x, y, z.
Nếu tạo muối trung hòa ta có các phản ứng:
MO + H2SO4 →MSO4 + H2O (1)
M(OH)2 + H2SO4 →MSO4 + 2H2O (2)
MCO3 + H2SO4 →MSO4 + H2O + CO2 (3)
Nếu tạo muối axít ta có các phản ứng:
MO + 2H2SO4 →M(HSO4)2 + H2O (4)
M(OH)2 + 2H2SO4 →M(HSO4)2 + 2H2O (5)
MCO3 + 2H2SO4 →M(HSO4)2 + H2O + CO2 (6)
Ta có :
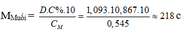
– TH1: Nếu muối là MSO4 M + 96 = 218 M = 122 (loại)
– TH2: Nếu là muối M(HSO4)2 M + 97.2 = 218 M = 24 (Mg)
Vậy xảy ra phản ứng (4, 5, 6) tạo muối Mg(HSO4)2
b) Theo (4, 5, 6) Số mol CO2 = 0,448/22,4 = 0,02 molz = 0,02 (I)
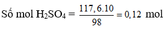
2x + 2y + 2z = 0,12 (II)
Đề bài: 40x + 58y + 84z = 3,64 (III)
Giải hệ (I, II, III): x = 0,02; y = 0,02; z = 0,02
%MgO = 40.0,02.100/3,64 = 21,98%
%Mg(OH)2 = 58.0,02.100/3,64 = 31,87%
%MgCO3 = 84.0,02.100/3,64 = 46,15%
Đúng 0
Bình luận (0)
cho 200(g) BaCl2 10,4(%) tác dụng vừa đủ với dung dịch H2SO4 (41,9%). a) viết phương trình phản ứng xảy ra. b) nếu cho quỳ tím cho vào dung dịch sau phản ứng quỳ tím có màu gì? c) tính khối lượng chất kết tủa tạo thành. d) tính khối lượng dung dịch H2SO4 4,9(%) đã dùng. e) tính nồng độ phần trăm dung dịch sau phản ứng
\(n_{BaCl_2}=\dfrac{200.10,4\%}{208}=0,1\left(mol\right)\\ a,BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\\ b,Qu\text{ỳ}-t\text{í}m-ho\text{á}-\text{đ}\text{ỏ}-do-c\text{ó}-\text{ax}it-HCl\\ c,n_{BaSO_4}=n_{H_2SO_4}=n_{BaCl_2}=0,1\left(mol\right)\\ m_{k\text{ết}-t\text{ủa}}=m_{BaSO_4}=233.0,1=23,3\left(g\right)\\ d,m_{\text{dd}H_2SO_4}=\dfrac{0,1.98}{4,9\%}=200\left(g\right)\\ e,m_{\text{dd}HCl}=200+200-23,3=376,7\left(g\right)\\ n_{HCl}=0,1.2=0,2\left(mol\right)\\ C\%_{\text{dd}HCl}=\dfrac{0,2.36,5}{376,7}.100\approx1,938\%\)
Đúng 1
Bình luận (0)


















