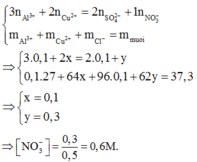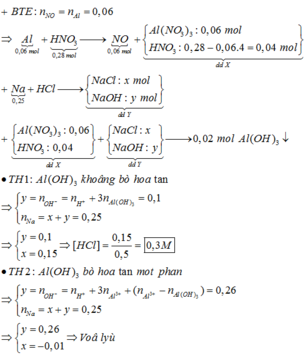cho 500 gam dung dịch H2SO414,7%só mol của H2SO4có trong dung dịch là

Những câu hỏi liên quan
Câu 8: Cho 99,4 gam P2O5 vào 500 gam nước (dư), thu được dung dịch A.
a. Tính khối lượng chất tan, khối lượng nước trong dung dịch A.
b. Tính nồng độ phần trăm dung dịch A.
c. Tính nồng độ mol/l của dung dịch A. Biết thể tích dung dịch A là 500 ml.
giúp vs ae
\(n_{P_2O_5}=\dfrac{99,4}{142}=0,7\left(mol\right)\)
\(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
0,7 2,1 1,4
a, \(m_{H_3PO_4}=1,4.98=137,2\left(g\right)\)
\(m_{ddH_3PO_4}=99,4+500=599,4\left(g\right)\)
Kl nước trong dd A :
\(m_{H_2O}=599,4-137,2=462,2\left(g\right)\)
\(b,C\%_{H_3PO_4}=\dfrac{137,2}{599,4}.100\%\approx22,89\%\)
\(c,C_M=\dfrac{n}{V}=\dfrac{1,4}{0,5}=2,8M\)
Đúng 2
Bình luận (0)
Trong 500 ml dung dịch có chứa 10 gam NaOH, nồng độ mol của dung dịch là
Dung dịch X chứa các ion sau: Al3+, Cu2+,
S
O
4
2
-
và
N
O
3
-
. Để kết tủa hết ion có trong 250 ml dung dịch X cần 50 ml dung dịch BaC2 1M. Cho 500 ml dung dịch X tác dụng với dung dịch NH3 dư thì được 7,8 gam kết tủa. Cô cạn 500 ml dung dịch X được 37,3 gam hỗn hợp muối khan. Nồng độ mol/l của
N
O...
Đọc tiếp
Dung dịch X chứa các ion sau: Al3+, Cu2+, S O 4 2 - và N O 3 - . Để kết tủa hết ion có trong 250 ml dung dịch X cần 50 ml dung dịch BaC2 1M. Cho 500 ml dung dịch X tác dụng với dung dịch NH3 dư thì được 7,8 gam kết tủa. Cô cạn 500 ml dung dịch X được 37,3 gam hỗn hợp muối khan. Nồng độ mol/l của N O 3 - là:
A. 0,2M.
B. 0,3M.
C. 0,6M.
D. 0,4M.
Dung dịch X chứa các ion sau: Al3+, Cu2+, SO42- và NO3-. Để kết tủa hết ion SO42- có trong 250 ml dung dịch X cần 50 ml dung dịch BaCl2 1M. Cho 500 ml dung dịch X tác dụng với dung dịch NH3 dư thì thu được 7,8 gam kết tủa Làm bay hơi hết nước có trong 500 ml dung dịch X được 37,3 gam hỗn hợp muối khan. Nồng độ mol của NO3- trong dung dịch X là A. 0,3M. B. 0,6M C. 0,2M D. 0,4M
Đọc tiếp
Dung dịch X chứa các ion sau: Al3+, Cu2+, SO42- và NO3-. Để kết tủa hết ion SO42- có trong 250 ml dung dịch X cần 50 ml dung dịch BaCl2 1M. Cho 500 ml dung dịch X tác dụng với dung dịch NH3 dư thì thu được 7,8 gam kết tủa Làm bay hơi hết nước có trong 500 ml dung dịch X được 37,3 gam hỗn hợp muối khan. Nồng độ mol của NO3- trong dung dịch X là
A. 0,3M.
B. 0,6M
C. 0,2M
D. 0,4M
Dung dịch X chứa các ion sau: Al3+, Cu2+, SO42- và NO3-. Để kết tủa hết ion SO42- có trong 250 ml dung dịch X cần 50 ml dung dịch BaCl2 1M. Cho 500 ml dung dịch X tác dụng với dung dịch NH3 dư thì được 7,8 gam kết tủa. Làm bay hơi hết nước có trong 500 ml dung dịch X được 37,3 gam hỗn hợp muối khan. Nồng độ mol của NO3- trong dung dịch X là A. 0,3M B. 0,6M C. 0,2M D. 0,4M
Đọc tiếp
Dung dịch X chứa các ion sau: Al3+, Cu2+, SO42- và NO3-. Để kết tủa hết ion SO42- có trong 250 ml dung dịch X cần 50 ml dung dịch BaCl2 1M. Cho 500 ml dung dịch X tác dụng với dung dịch NH3 dư thì được 7,8 gam kết tủa. Làm bay hơi hết nước có trong 500 ml dung dịch X được 37,3 gam hỗn hợp muối khan. Nồng độ mol của NO3- trong dung dịch X là
A. 0,3M
B. 0,6M
C. 0,2M
D. 0,4M
Đáp án : B
250 ml X phản ứng với 50 ml BaCl2
=> 500 ml X phản ứng với 100 ml BaCl2 => nSO4 = nBa2+ = 0,1 mol
X phản ứng với NH3 => tạo kết tủa Al(OH)3 ( Cu(OH)2 tan trong NH3)
=> nAl3+ = nAl(OH)3 = 0,1 mol
Trong X : Bảo toàn điện tích : 3nAl3+ + 2nCu2+ = nNO3- + 2nSO42-
Laij cos : mmuối X = 27.nAl3+ + 64nCu2+ + 62nNO3 + 96nSO4 = 37,3g
=> nNO3- = 0,3 mol
=> CM(NO3-) = 0,6M
Đúng 0
Bình luận (0)
Cho 500 ml dung dịch glucozơ phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3 (đun nóng), thu được 10,8 gam Ag. Nồng độ mol của dung dịch glucozơ đã dùng là A. 0,20M B. 0,01M C. 0,02M D. 0,10M
Đọc tiếp
Cho 500 ml dung dịch glucozơ phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3 (đun nóng), thu được 10,8 gam Ag. Nồng độ mol của dung dịch glucozơ đã dùng là
A. 0,20M
B. 0,01M
C. 0,02M
D. 0,10M
Cho 500 ml dung dịch glucozơ phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3 (đun nóng), thu được 10,8 gam Ag. Nồng độ mol của dung dịch glucozơ đã dùng là A. 0,20M. B. 0,01M. C. 0,02M. D. 0,10M.
Đọc tiếp
Cho 500 ml dung dịch glucozơ phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3 (đun nóng), thu được 10,8 gam Ag. Nồng độ mol của dung dịch glucozơ đã dùng là
A. 0,20M.
B. 0,01M.
C. 0,02M.
D. 0,10M.
Hòa tan hoàn toàn 1,62 gam Al trong 280 ml dung dịch HNO3 1M, thu được dung dịch X và khí NO (sản phẩm khử duy nhất). Cho 5,75 gam kim loại Na và 500 ml dung dịch HCl, thu được dung dịch Y. Trộn dung dịch X với dung dịch Y tạo thành 1,56 gam kết tủa. Nồng độ mol của dung dịch HCl là A. 3M. B. 0,3M. C. 0,15M. D. 1,5M.
Đọc tiếp
Hòa tan hoàn toàn 1,62 gam Al trong 280 ml dung dịch HNO3 1M, thu được dung dịch X và khí NO (sản phẩm khử duy nhất). Cho 5,75 gam kim loại Na và 500 ml dung dịch HCl, thu được dung dịch Y. Trộn dung dịch X với dung dịch Y tạo thành 1,56 gam kết tủa. Nồng độ mol của dung dịch HCl là
A. 3M.
B. 0,3M.
C. 0,15M.
D. 1,5M.
Cho 500 ml dung dịch glucozơ phản ứng hoàn toàn với lượng vừa đủ dung dịch AgNO3 trong NH3 (đun nóng), thu được 10,8 gam Ag. Nồng độ mol của dung dịch glucozơ đã dùng là:
A. 0,01 M.
B. 0,20 M.
C. 0,02 M.
D. 0,10 M.