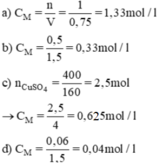a) Tính nồng độ CM của dung dịch 0,6 mol MgCL2 trong 1600 ml dung dịch

Những câu hỏi liên quan
Hãy tính nồng độ mol của mỗi dung dịch sau:
a) 1 mol KCl trong 750 ml dung dịch.
b) 0,5 mol MgCl2 trong 1,5 lít dung dịch
Trả lời hộ cái
750ml=0.75l
a) nồng độ mol = 1/0.75=4/3(M)
b)nồng độ mol = 0.5/1.5=1/3 (M)
Cấm sao chép dưới mọi hình thức
Đúng 0
Bình luận (0)
Trộn 200 ml dung dịch AgNO3 0,25M với 300 ml dung dịch MgCl2 0,1M thu được dung dịch X và a
gam kết tủa Y.
1.Viết PTPU và tính a ?
2.Tính nồng độ mol của mỗi chất trong dung dịch X ?
giúp tớ với huhu
\(n_{AgNO_3}=0,25\cdot0,2=0,05\left(mol\right);n_{MgCl_2}=0,1\cdot0,3=0,03\left(mol\right)\\ a,PTHH:2AgNO_3+MgCl_2\rightarrow2AgCl\downarrow+Mg\left(NO_3\right)_2\\ \text{Vì }\dfrac{n_{AgNO_3}}{2}< \dfrac{n_{MgCl_2}}{1}\text{ nên sau phản ứng }MgCl_2\text{ dư}\\ \Rightarrow n_{AgCl}=n_{AgNO_3}=0,05\left(mol\right)\\ \Rightarrow a=m_{AgCl}=0,05\cdot143,5=7,175\left(g\right)\\ 2,n_{Mg\left(NO_3\right)_2}=\dfrac{1}{2}n_{AgNO_3}=0,025\left(mol\right)\\ \Rightarrow C_{M_{Mg\left(NO_3\right)_2}}=\dfrac{0,025}{0,2+0,3}=0,05M\)
Đúng 1
Bình luận (0)
Đáp án:
CÂU 3:
1)1) PTHH: 2AgNO3+MgCl2→2AgCl↓+Mg(NO3)22AgNO3+MgCl2→2AgCl↓+Mg(NO3)2
nAgNO3=0,2×0,25=0,05(mol)nAgNO3=0,2×0,25=0,05(mol)
nMgCl2=0,3×0,1=0,03(mol)nMgCl2=0,3×0,1=0,03(mol)
Xét nMgCl21nMgCl21
→ AgNO3AgNO3 hết, MgCl2MgCl2 dư.
Tính theo số mol AgNO3AgNO3
→ nMg(NO3)2=12×0,05=0,025(mol)nMg(NO3)2=12×0,05=0,025(mol)
⇒ a=mAgCl=0,05×143,5=7,175(g)a=mAgCl=0,05×143,5=7,175(g)
b)b) - Dung dịch aa gồm: MgCl2MgCl2 dư và Mg(NO3)2Mg(NO3)2
Xem như thể tích dung dịch sau phản ứng thay đổi không đáng kể.
→ Vdd=0,2+0,3=0,5(l)Vdd=0,2+0,3=0,5(l)
⇒ C(M)Mg(NO3)2=0,0250,5=0,05(M)
Đúng 0
Bình luận (0)
Câu 1:
a)òa tan 15g NaCl và 45g nước.Tính nồng dộ phần trăm của dung dịch.
b)Hãy tính nồng độ mol của 0,5 mol MgCl2 trong 1,5 lít dung dịch.
Câu 2:Hãy tính số mol và sô gam chất tan có trong mỗi dung dịch sau:
a)1 lít dung dịch NaOH 0,5M
b)500 ml dung dịch HCl 0,2M
Câu 1:
a) \(C\%=\dfrac{15}{15+45}.100\%=25\%\)
b) \(C_M=\dfrac{0,5}{1,5}=0,33M\)
Câu 2:
a) \(n_{NaOH}=0,5.1=0,5\left(mol\right)=>m_{NaOH}=0,5.40=20\left(g\right)\)
b) \(n_{HCl}=0,2.0,5=0,1\left(mol\right)=>m_{HCl}=0,1.36,5=3,65\left(g\right)\)
Đúng 1
Bình luận (0)
Cho 100 ml dung dịch MgCl2 1M phản ứng với 100 ml dung dịch AgNO3 0,8M thu được m gam kết tủa và 200 ml dung dịch X. Tính m và nồng độ mol mỗi chất tan trong X.
MgCl2+2AgNO3->Mg(NO3)2+2AgCl
0,04-----0,08-----------0,04----------0,08
n MgCl2=0,1 mol
n AgNO3=0,08 mol
=>Mgcl2 dư
=>m AgCl=0,08.143,5=11,48g
=>CMMg(NO)2=\(\dfrac{0,04}{0,2}\)=0,2M
=>CMMgcl2 dư=\(\dfrac{0,06}{0,2}\)=0,3M
Đúng 3
Bình luận (0)
\(n_{MgCl_2}=0,1\cdot1=0,1mol\)
\(n_{AgNO_3}=0,1\cdot0,8=0,08mol\)
\(MgCl_2+2AgNO_3\rightarrow2AgCl\downarrow+Mg\left(NO_3\right)_2\)
0,1 0,08 0 0
0,04 0,08 0,08 0,04
0,06 0 0,08 0,04
\(m_{\downarrow}=0,08\cdot143,5=11,48g\)
\(C_{M_{Mg\left(NO_3\right)_2}}=\dfrac{n_{Mg\left(NO_3\right)_2}}{V_X}=\dfrac{0,04}{0,2}=0,2M\)
Đúng 2
Bình luận (1)
\(n_{MgCl_2}=0,1.1=0,1\left(mol\right)\\ n_{AgNO_3}=0,1.0,8=0,08\left(mol\right)\)
PTHH: MgCl2 + 2AgNO3 ---. 2AgCl + Mg(NO3)2
LTL: \(0,1>\dfrac{0,08}{2}\rightarrow\) MgCl2 dư
Theo pthh: \(\left\{{}\begin{matrix}n_{MgCl_2\left(pư\right)}=n_{Mg\left(NO_3\right)_2}=\dfrac{0,08}{2}=0,04\left(mol\right)\\n_{AgCl}=0,08\left(mol\right)\end{matrix}\right.\)
\(\rightarrow C_M_{MgCl_2\left(dư\right)}==\dfrac{0,1-0,04}{0,2}=0,3M\\ C_{MMg\left(NO_3\right)_2}=\dfrac{0,04}{0,2}=0,2M\)
\(m_{AgCl}=143,5.0,08=11,48\left(g\right)\)
Đúng 1
Bình luận (1)
a) Tính nồng độ phần trăm của dung dịch : 16g CuSO4 trong 250g dung dịch
b) Tính số mol chất tan có trong 200ml dung dịch NaCl 0,25M
c) Tính nồng độ phần trăm của dung dịch : 10g MgCl2 trong 200g dung dịch
d) Tính số mol chất tan có trong 300 ml dung djch KNO3 0,05M
e) Tính nồng đồ phần trăm của dung dịch: 10g MgCl2 trong 80g dung dịch
f) Tính số mol chất tan có trong 300ml dung dịch KNO3 0,005M
helppp với ạ :((((((((
Đọc tiếp
a) Tính nồng độ phần trăm của dung dịch : 16g CuSO4 trong 250g dung dịch
b) Tính số mol chất tan có trong 200ml dung dịch NaCl 0,25M
c) Tính nồng độ phần trăm của dung dịch : 10g MgCl2 trong 200g dung dịch
d) Tính số mol chất tan có trong 300 ml dung djch KNO3 0,05M
e) Tính nồng đồ phần trăm của dung dịch: 10g MgCl2 trong 80g dung dịch
f) Tính số mol chất tan có trong 300ml dung dịch KNO3 0,005M
helppp với ạ :((((((((
Bài 2. Cho 500 mL dung dịch X chứa FeCl3 và MgCl2 tác dụng vừa đủ với 200 mL dung dịch KOH 2,5M, sau phản ứng thu được 16,5 gam kết tủa. Tính nồng độ mol của các chất tan trong dung dịch X.
Gọi: \(\left\{{}\begin{matrix}n_{FeCl_3}=x\left(mol\right)\\n_{MgCl_2}=y\left(mol\right)\end{matrix}\right.\)
PT: \(FeCl_3+3KOH\rightarrow Fe\left(OH\right)_{3\downarrow}+3KCl\)
______x_________3x_________x (mol)
\(MgCl_2+2KOH\rightarrow Mg\left(OH\right)_{2\downarrow}+2KCl\)
____y_________2y_________y (mol)
Ta có: \(n_{KOH}=0,2.2,5=0,5\left(mol\right)\)
⇒ 3x + 2y = 0,5 (1)
m kết tủa = 16,5 ⇒ 107x + 58y = 16,5 (2)
Từ (1) và (2) ⇒ x = y = 0,1 (mol)
\(\Rightarrow C_{M_{FeCl_3}}=C_{M_{MgCl_2}}=\dfrac{0,1}{0,5}=0,2\left(M\right)\)
Đúng 3
Bình luận (0)
\(FeCl_3+3KOH\rightarrow Fe\left(OH\right)_3\downarrow+3KCl\\ MgCl_2+2KOH\rightarrow Mg\left(OH\right)_2\downarrow+2KCl\)
\(n_{KOH}=0,2\cdot2,5=0,5\left(mol\right)\)
Đặt nFeCl₃ trong 500ml X là a mol, nMgCl₂ trong 500ml X là b mol
\(\Rightarrow\left\{{}\begin{matrix}3a+2b=0,5\\107a+58b=16,5\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(\Rightarrow C_MFeCl_3=\dfrac{0,1}{0,5}=0,2\left(M\right)\\ C_MMgCl_2=\dfrac{0,1}{0,5}=0,2\left(M\right)\)
Đúng 1
Bình luận (0)
Hãy tính nồng độ mol của mỗi dung dịch sau:
a) 1 mol KCl trong 750ml dung dịch.
b) 0,5 mol MgCl2 trong 1,5 lít dung dịch.
c) 400g CuSO4 trong 4 lít dung dịch.
d) 0,06 mol Na2CO3 trong 1500ml dung dịch.
hãy tính nồng độ mol của dung dịch sau: 0,5 mol MgCl 2 trong 1,5 lít dung dịch
Hãy tính nồng độ mol của những dung dịch sau :
A. 0,5 mol MgCl2 trong 1,5 lít dung dịch
B. 400 gam CuSO4 trong 4 lít dung dịch
a) CM MgCl2 = 0,5/1,5 = 0,33M
b) n CuSO4 = 400/160 = 2,5(mol)
CM CuSO4 = 2,5/4 = 0,625M
Đúng 1
Bình luận (0)
a) `CM_(MgCl_2) = (0,5)/(1,5)`\(\approx\)`0,33 M`
b) `n_(CuSO_4)=2,5(mol)`
→ `CM_(CuSO_4)=(2,5)/4=0,625 M`
Đúng 0
Bình luận (0)