Dẫn 3,36 lít khí etilen điều kiện tiêu chuẩn qua bình đựng 400ml dung dịch brom 0,5 M màu của dung dịch brom thay đổi như thế nào Giải thích

Những câu hỏi liên quan
Dẫn 6,72 lít khí ở điều kiện tiêu chuẩn gồm metan và etilen đi qua bình dung dịch nước brom đã làm mất màu hoàn toàn dung dịch chứa 6gam brom . Tính thành phần , phần trăm về thể tích mỗi chất có trong hỗn hợp
Ta có: \(n_{Br_2}=\dfrac{6}{160}=0,0375\left(mol\right)\)
PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Theo PT: \(n_{C_2H_4}=n_{Br_2}=0,0375\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,0375.22,4}{6,72}.100\%=12,5\%\\\%V_{CH_4}=87,5\%\end{matrix}\right.\)
Đúng 3
Bình luận (0)
Ở điều kiện tiêu chuẩn 3,36 lít hỗn hợp khí gồm CH4 và C2H4 có khối lượng 3 gam A Tính phần trăm theo thể tích và theo khối lượng mỗi khí trong hỗn hợp B Dẫn 3,36 lít hỗn hợp khí trên qua bình chứa dung dịch brom dư thấy dung dịch Brom bị nhạt màu và khối lượng tăng thêm M gam. Tính m
a, Ta có: \(n_{CH_4}+n_{C_2H_4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\left(1\right)\)
\(16n_{CH_4}+28n_{C_2H_4}=3\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CH_4}=0,1\left(mol\right)\\n_{C_2H_4}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CH_4}=\dfrac{0,1.16}{3}.100\%\approx53,33\%\\\%m_{C_2H_4}\approx46,67\%\end{matrix}\right.\)
- Ở cùng điều kiện nhiệt độ và áp suất, % số mol cũng là %V.
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,1}{0,15}.100\%\approx66,67\%\\\%V_{C_2H_4}\approx33,33\%\end{matrix}\right.\)
b, PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Có: m tăng = mC2H4 = 0,05.28 = 1,4 (g)
Đúng 1
Bình luận (0)
a) \(n_{hh}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{CH_4}=a\left(mol\right)\\n_{C_2H_4}=b\left(mol\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a+b=0,15\\16a+28b=3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,05\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,1}{0,15}.100\%=66,67\%\\\%V_{C_2H_4}=100\%-66,67\%=33,33\%\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CH_4}=\dfrac{0,1.16}{3}.100\%=53,33\%\\\%m_{C_2H_4}=100\%-53,33\%=46,67\%\end{matrix}\right.\)
b) \(m=m_{C_2H_4}=0,05.28=1,4\left(g\right)\)
Đúng 2
Bình luận (0)
Cho 4,3 g hỗn hợp khí m gồm metan etilen axetilen qua bình đựng dung dịch brom dư thấy có 0,15 mol brom đã phản ứng. Mặt khác đốt cháy hoàn toàn 8,96 lít (điều kiện tiêu chuẩn) hỗn hợp m toàn bộ sản phẩm cháy được dẫn qua bình đựng h2 SO4 đặc dư thấy khối lượng bình axit tăng 12,6 gam . xác định thành phần phần trăm thể tích mỗi khí trong hỗn hợp m Giúp em với ạ : Em cần gấp Em cảm ơn ạ
Đọc tiếp
Cho 4,3 g hỗn hợp khí m gồm metan etilen axetilen qua bình đựng dung dịch brom dư thấy có 0,15 mol brom đã phản ứng. Mặt khác đốt cháy hoàn toàn 8,96 lít (điều kiện tiêu chuẩn) hỗn hợp m toàn bộ sản phẩm cháy được dẫn qua bình đựng h2 SO4 đặc dư thấy khối lượng bình axit tăng 12,6 gam . xác định thành phần phần trăm thể tích mỗi khí trong hỗn hợp m
Giúp em với ạ :<
Em cần gấp
Em cảm ơn ạ
Gọi n CH4 = a(mol) ; n C2H4 = b(mol) ; n C2H2 = c(mol)
=> 16a + 28b + 26c = 4,3(1)
$C_2H_4 + Br_2 \to C_2H_4Br_2$
$C_2H_2 + 2Br_2 \to C_2H_2Br_4$
n Br2 = b + 2c = 0,15(2)
Mặt khác :
m H2O = m tăng = 12,6 gam
=> n H2O = 0,7(mol)
n X = 8,96/22,4 = 0,4(mol)
Bảo toàn nguyên tố với H :
n H2O = 2n CH4 + 2n C2H4 + n C2H2
Ta có :
\(\dfrac{n_X}{n_{H_2O}} = \dfrac{a + b + c}{2a + 2b + c} = \dfrac{0,4}{0,7}(3)\)
Từ (1)(2)(3) suy ra a = 0,1 ; b = 0,05 ; c = 0,05
%V CH4 = 0,1/(0,1 + 0,05 + 0,05) .100% = 50%
%V C2H4 = %V C2H2 = 0,05/(0,1 + 0,05 + 0,05) .100% = 25%
Đúng 1
Bình luận (0)
dẫn V lít điều kiện tiêu chuẩn hỗn hợp x gồm metan và etilen qua bình đựng dung dịch brom dư sau phản ứng xong thấy khối lượng bình tăng lên 2,8 g cùng với V lít hỗn hợp x đem đốt cháy thu được 11 gam khí CO2
a Tính giá trị P và điều kiện tiêu chuẩn
b tính phần trăm về thể tích hỗn hợp X
Trong hai khí trên, chỉ có khí etilen tác dụng với dung dịch nước brom, khối lượng bình tăng bằng khối lượng khí etilen tham gia phản ứng, suy ra số mol của khí etilen là 2,8/28=0,1 (mol).
Khí đem đốt cháy là khí metan, số mol khí metan bằng số mol khí CO2 sinh ra (bảo toàn nguyên tố cacbon) và bằng 11/44=0,25 (mol).
a. Giá trị V=(0,25+0,1).22,4=7,84 (lít).
b. Phần trăm thể tích mỗi khí:
%Vmetan=0,25/0,35.100%\(\approx\)71,43%, suy ra %Vetilen\(\approx\)100%-71,43%\(\approx\)28,57%.
Đúng 1
Bình luận (0)
Dẫn 3,36 lít khí etilen (đktc) qua bình đựng dung dịch brom dư thấy khối lượng bình tăng m gam. m có giá trị
\(n_{C_2H_4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
mtăng = mC2H4 = 0,15.28 = 4,2 (g)
Đúng 7
Bình luận (0)
Dẫn 6,72 (l) etilen ở điều kiện tiêu chuẩn đi qua dung dịch brom 0,5M, nhận
thấy dung dịch brom bị mất màu da cam.
a/ Viết phương trình hóa học của phản ứng.
b/ Tính thể tích dung dịch brom đã tham gia phản ứng.
c/ Tính khối lượng của sản phẩm thu đượ
tớ làm gòi mà bạn, bạn xem lại thông báo nhé!
Đúng 3
Bình luận (0)
Dẫn 5,6 lít (đktc) khí metan và etilen đi qua bình đựng dung dịch nước brom, đã làm mất màu hoàn toàn dung dịch có chứa 4 gam brom. Thể tích khí metan (đktc) trong hỗn hợp là
A. 0,56 lít.
B. 5,04 lít.
C. 0,28 lít.
D. 3,36 lít
Dẫn 2 khí qua dung dịch nước brom chỉ có C 2 H 4 phản ứng
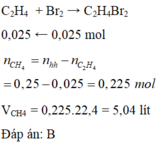
Đúng 0
Bình luận (0)
Dẫn 3,36 lit khí etilen ở đktc qua dung dịch chứa 20 gam brom. Hiện tượng quan sát được là:
Màu vàng của dung dịch không thay đổi.
Màu vàng của dung dịch brom nhạt hơn lúc đầu.
Màu vàng nhạt dần và dung dịch chuyển thành trong suốt.
Màu vàng sẽ đậm hơn lúc đầu.
Màu vàng của dung dịch brom nhạt hơn lúc đầu.
Đúng 1
Bình luận (0)
Màu vàng của dung dịch brom nhạt hơn lúc đầu
Đúng 2
Bình luận (0)
Xem thêm câu trả lời
Dẫn 5,6 lít (đktc) khí metan và etilen đi qua bình đựng dung dịch nước brom, đã làm mất màu hoàn toàn dung dịch có chứa 4 gam brom. Tính thành phần phần trăm theo thể tích mỗi chất khí có trong hỗn hợp?
\(n_{hh\left(CH_4,C_2H_4\right)}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\\ n_{Br_2}=\dfrac{4}{160}=0,025\left(mol\right)\\ C_2H_4+Br_2\rightarrow C_2H_4Br_2\\ n_{C_2H_4}=n_{Br_2}=0,025\left(mol\right)\)
Vì số mol tỉ lệ thuận với thể tích, nên ta có:
\(\%n_{C_2H_4}=\dfrac{0,025}{0,25}.100\%=10\%\\ \Rightarrow\%V_{C_2H_4}=10\%;\%V_{CH_4}=100\%-10\%=90\%\)
Đúng 0
Bình luận (0)




























