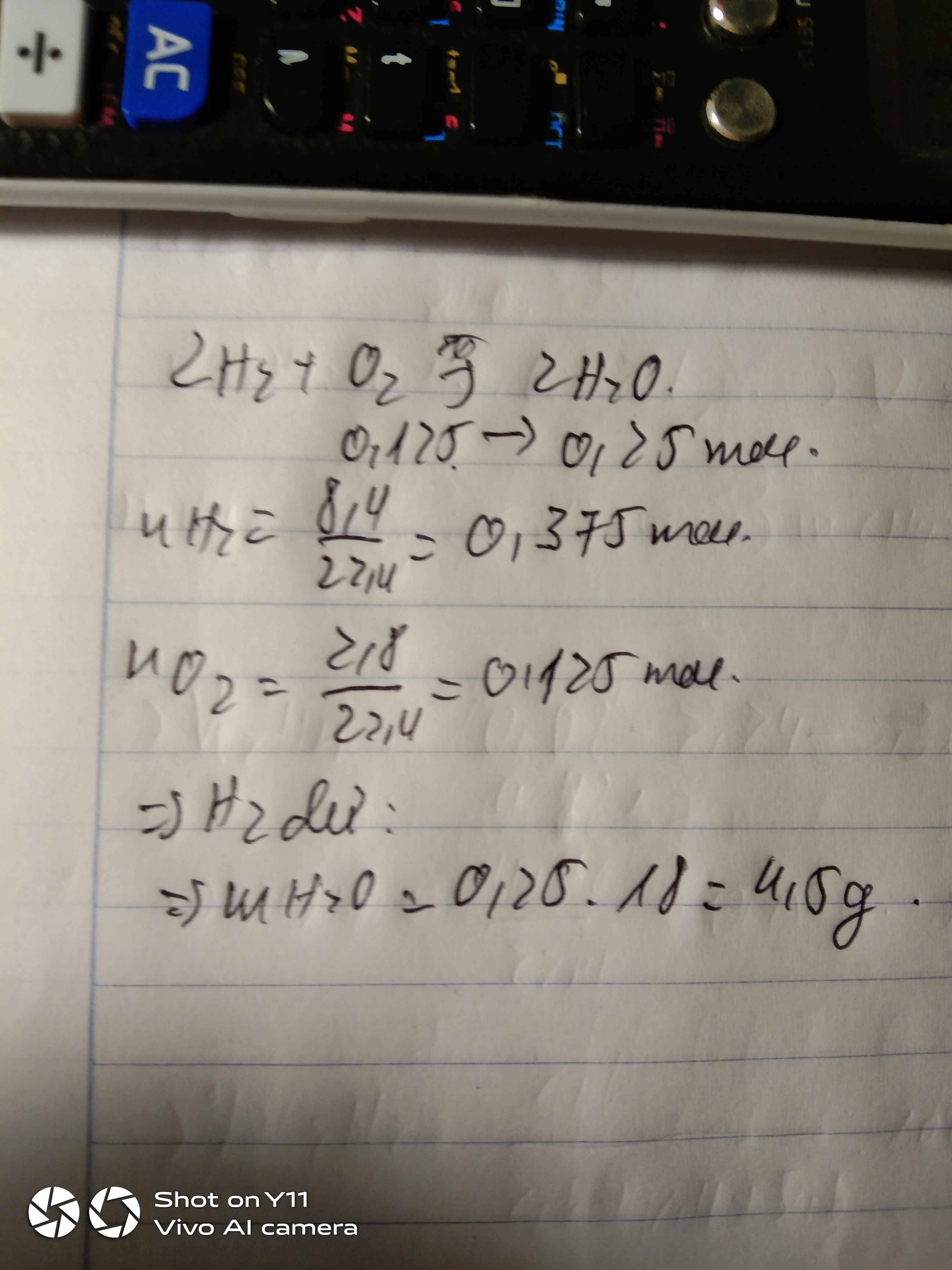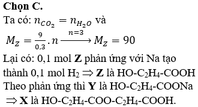Cho 2,24 lít khí hidro (đktc) tác dụng với 6,72 lít khí oxi (đktc) thu được m gam H2O. Tính m

Những câu hỏi liên quan
Hỗn hợp X gồm Fe và Cu-Nếu cho m gam X tác dụng với HCl dư kết thúc thu được 2,24 lít khí H2 (đktc).-Nếu cho m gam X tác dụng với Cl2 thì hết 6,72 lít khí Cl2 (đktc).a) Viết các PTHH.b) Tính thành phần % các kim loại trong X.***Nhân tiện có bạn nào hiểu cách xác định chất nào đứng trước chất nào đứng sau trong dãy hoạt động hóa học của kim loại thì giải thích cho mình với được không ạ??Gần thi cử đến nơi mà học chẳng hiểu...
Đọc tiếp
Hỗn hợp X gồm Fe và Cu
-Nếu cho m gam X tác dụng với HCl dư kết thúc thu được 2,24 lít khí H2 (đktc).
-Nếu cho m gam X tác dụng với Cl2 thì hết 6,72 lít khí Cl2 (đktc).
a) Viết các PTHH.
b) Tính thành phần % các kim loại trong X.
***Nhân tiện có bạn nào hiểu cách xác định chất nào đứng trước chất nào đứng sau trong dãy hoạt động hóa học của kim loại thì giải thích cho mình với được không ạ??Gần thi cử đến nơi mà học chẳng hiểu...
a) PTHH : \(Fe+2HCl-t^o->FeCl_2+H_2\) (1)
\(2Fe+3Cl_2-t^o->2FeCl_3\) (2)
\(Cu+Cl_2-t^o->CuCl_2\) (3)
b) Theo pthh (1) : \(n_{Fe}=n_{H2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,1.56=5,6\left(g\right)\)
Theo pthh (2) và (3) : \(\Sigma n_{Cl2}=\dfrac{3}{2}n_{Fe}+n_{Cu}\)
\(\Rightarrow\dfrac{6,72}{22,4}=\dfrac{3}{2}.0,1+n_{Cu}\)
\(\Rightarrow0,3=0,15+n_{Cu}\)
\(\Rightarrow n_{Cu}=0,15\left(mol\right)\)
\(\Rightarrow m_{Cu}=0,15.64=9,6\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{5,6}{5,6+9,6}\cdot100\%\approx36,84\%\\\%m_{Cu}=100\%-36,84\%=63,16\%\end{matrix}\right.\)
Đúng 0
Bình luận (0)
Cho m (gam) hỗn hợp Al, Mg tác dụng với dung dịch HCl dư thu được 12,32 lít khí (đktc). Mặt khác, cũng m (gam) hỗn hợp trên cho tác dụng với dung dịch NaOH dư thu được 6,72 lít khí (đktc). Tính giá trị của m
A. 28,2 gam
B. 22,8 gam
C. 14,1 gam
D. 11,4 gam
tính số gam nước thu được khi cho 8,4 lít khí hidro tác dụng với 2,8 lít khí oxi (các thể tích khí đo ở đktc)
\(n_{H_2}=\dfrac{8.4}{22,4}=0,375\left(mol\right)\)
\(n_{O_2}=\dfrac{2.8}{22,4}=0,125\left(mol\right)\)
PTHH : 2H2 + O2 -> 2H2O
0,125 0,25
Ta thấy : 0,375 > 0,125 => H2 dư , O2 đủ
\(m_{H_2O}=0,25.18=4,5\left(g\right)\)
Đúng 4
Bình luận (0)
\(n_{H_2}=\dfrac{V_{H_2}}{22,4}=\dfrac{8,4}{22,4}=0,375mol\)
\(n_{O_2}=\dfrac{V_{O_2}}{22,4}=\dfrac{2,8}{22,4}=0,125mol\)
\(2H_2+O_2\rightarrow\left(t^o\right)2H_2O\)
0,375 >0,125 ( mol )
0,125 0,25 ( mol )
\(m_{H_2O}=n_{H_2O}.M_{H_2O}=0,25.18=4,5g\)
Đúng 2
Bình luận (1)
Cho m gam hỗn hợp X gồm Mg và Al vào dung dịch HCl dư thu được 8,96 lít khí. Mặt khác, cho m gam hỗn hợp X tác dụng với dung dịch NaOH dư, thu được 6,72 lít khí. Thể tích khí đo ở đktc. Giá trị của m là được 8,96 lít khí. Mặt khác, cho m gam hỗn hợp X tác dụng với dung dịch NaOH dư, thu được 6,72 lít khí. Thể tích khí đo ở đktc. Giá trị của m là A. 7,80. B. 14,55. C. 6,45. D. 10,2.
Đọc tiếp
Cho m gam hỗn hợp X gồm Mg và Al vào dung dịch HCl dư thu được 8,96 lít khí. Mặt khác, cho m gam hỗn hợp X tác dụng với dung dịch NaOH dư, thu được 6,72 lít khí. Thể tích khí đo ở đktc. Giá trị của m là được 8,96 lít khí. Mặt khác, cho m gam hỗn hợp X tác dụng với dung dịch NaOH dư, thu được 6,72 lít khí. Thể tích khí đo ở đktc. Giá trị của m là
A. 7,80.
B. 14,55.
C. 6,45.
D. 10,2.
Cho các phương trình phản ứng: X + 2NaOH 2Y + H2O ; Y + HCl Z + NaCl Đốt cháy hoàn toàn 9,00 gam chất Z chỉ thu được 6,72 lít khí CO2 (đktc) và 5,40 gam nước. Mặt khác 9,00 gam chất Z tác dụng với Na dư, thu được 2,24 lít khí H2 (đktc) và 13,40 gam một muối khan. Công thức phân tử của chất X là A. C8H14O6 B. C4H6O5. C. C6H10O5 D. C6H10O6
Đọc tiếp
Cho các phương trình phản ứng:
X + 2NaOH 2Y + H2O ;
Y + HCl Z + NaCl
Đốt cháy hoàn toàn 9,00 gam chất Z chỉ thu được 6,72 lít khí CO2 (đktc) và 5,40 gam nước. Mặt khác 9,00 gam chất Z tác dụng với Na dư, thu được 2,24 lít khí H2 (đktc) và 13,40 gam một muối khan. Công thức phân tử của chất X là
A. C8H14O6
B. C4H6O5.
C. C6H10O5
D. C6H10O6
Có 100ml dung dịch X gồm: NH4+, K+, CO32-, SO42-. Chia dung dịch X làm 2 phần bằng nhau: -Phần 1 cho tác dụng với dung dịch Ba(OH)2 dư thu được 6,72 lít khí NH3 (đktc) và 43 gam kết tủa. -Phần 2 cho tác dụng với lượng dư dung dịch HCl thì thu được 2,24 lít khí CO2 (đktc). Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là: A. 24,9 B. 44,4 C. 49,8 D. 34,2
Đọc tiếp
Có 100ml dung dịch X gồm: NH4+, K+, CO32-, SO42-. Chia dung dịch X làm 2 phần bằng nhau:
-Phần 1 cho tác dụng với dung dịch Ba(OH)2 dư thu được 6,72 lít khí NH3 (đktc) và 43 gam kết tủa.
-Phần 2 cho tác dụng với lượng dư dung dịch HCl thì thu được 2,24 lít khí CO2 (đktc).
Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là:
A. 24,9
B. 44,4
C. 49,8
D. 34,2
Đáp án C
Gọi số mol mỗi ion NH4+, K+, CO32-, SO42- trong mỗi phần lần lượt là x, y, z , t mol
Phần 1: Ba2++ CO32-→ BaCO3
z z
Ba2++ SO42- → BaSO4
t t
NH4++ OH-→ NH3+ H2O
x x = 0,3 mol
mkết tủa= mBaCO3+ mBaSO4= 197z+233t= 43 suy ra t= 0,1 mol
Phần 2: 2H++ CO32- → CO2+ H2O
z mol z mol= 0,1
Định luật bảo toàn điện tích: x+y=2z+ 2t suy ra y= 0,1 mol
mmuối= (18x+ 39y+60z+96t).2= 49,8 gam
Đúng 0
Bình luận (0)
cho 4,47 lít khí hidro (ở đktc) tác dụng với khí õi thu được m gam nước
a) tính m
b) tính thể tích khi õi cần dùng ở đktc
\(H_2+\dfrac{1}{2}O_2-^{t^o}\rightarrow H_2O\)
\(n_{H_2}=\dfrac{4,47}{22,4}=0,2\left(mol\right)\)
\(n_{H_2O}=n_{H_2}=0,2\left(mol\right)\)
=> \(m_{H_2O}=0,2.18=3,6\left(g\right)\)
\(n_{O_2}=\dfrac{1}{2}n_{H_2}=0,1\left(mol\right)\)
=> \(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
Đúng 3
Bình luận (0)
Chắc là 4,48 lít nhở?
nH2=4,48/22,4=0,2(mol)
a) PTHH: H2 + 1/2 O2 -to-> H2O
nH2O=nH2=0,2(mol)
=>mH2O=0,2.18=3,6(g)
=>m=3,6(g)
b) nO2=1/2. 0,2=0,1(mol)
V(O2,đktc)=1/2.22,4=2,24(l)
Chúc em học tốt!
Đúng 2
Bình luận (0)
Bài 1:Cho 6 g NaOH tác dụng với m (g) H2SO4, thu được Na2SO4, H2O và H2SO4 dư. Sau phản ứng axit còn dư tác dụng vừa đủ với 13 g kẽm, thu được ZnSO4và V lít khí H2. Tính m và V ở đktc
Bài 2:Cho a gam khí H2 tác dụng với 2,24 lít khí oxi, thu được nước và khí hidro dư. Lượng khí H2 dư phản ứng vừa đủ với 8 gam CuO tạo thành đồng kim loại và nước. Tính a
Bài 1:
\(PTHH:2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\\ Zn+H_2SO_4\rightarrow ZnSO_4+H_2\\ n_{NaOH}=\dfrac{6}{40}=0,15\left(mol\right)\\ \Rightarrow n_{H_2SO_4}=\dfrac{1}{2}n_{NaOH}=\dfrac{1}{2}\cdot0,15=0,075\left(mol\right)\\ \Rightarrow m=m_{H_2SO_4}=0,075\cdot98=7,35\left(g\right)\\ n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\\ \Rightarrow n_{H_2}=0,2\left(mol\right)\\ \Rightarrow V=V_{H_2}=0,2\cdot22,4=4,48\left(l\right)\)
Đúng 1
Bình luận (0)
Có 100 ml dung dịch X gồm: NH4+, K+, CO32–, SO42–. Chia dung dịch X làm 2 phần bằng nhau. Phần 1 cho tác dụng với dung dịch Ba(OH)2 dư, thu được 6,72 lít (đktc) khí NH3 và 43 gam kết tủa. Phần 2 tác dụng với lượng dư dung dịch HCl, thu được 2,24 lít (đktc) khí CO2. Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là A. 24,9. B. 44,4. C. 49,8. D. 34,2.
Đọc tiếp
Có 100 ml dung dịch X gồm: NH4+, K+, CO32–, SO42–. Chia dung dịch X làm 2 phần bằng nhau. Phần 1 cho tác dụng với dung dịch Ba(OH)2 dư, thu được 6,72 lít (đktc) khí NH3 và 43 gam kết tủa. Phần 2 tác dụng với lượng dư dung dịch HCl, thu được 2,24 lít (đktc) khí CO2. Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là
A. 24,9.
B. 44,4.
C. 49,8.
D. 34,2.
Đáp án C
+ Bản chất phản ứng: P 2 : 2 H + + C O 3 2 - H 2 O + C O 2 ↑ ⇒ n C O 3 2 - = n C O 2 = 0 , 1 P 1 : N H 4 + + O H - N H 3 ↑ + H 2 O B a 2 + + C O 3 2 - B a C O 3 ↓ B a 2 + + S O 4 2 - B a S O 4 ↓ ⇒ n N H 4 + = n N H 3 = 0 , 3 n B a C O 3 = n C O 3 2 - = 0 , 1 n B a S O 4 = ( 43 - 0 , 1 . 197 ) : 233 = 0 , 1 + B T Đ T t r o n g m ộ t n ử a X : n K + = 2 n S O 4 2 - + 2 n C O 3 2 - - n N H 4 + = 0 , 1 m m u ố i t r o n g X = 2 ( m N H 4 + + m K + + m S O 4 2 - + m C O 3 2 - ) = 49 , 8 g a m
Đúng 0
Bình luận (0)