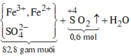
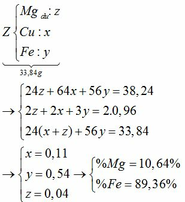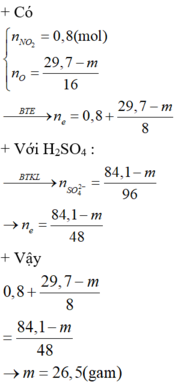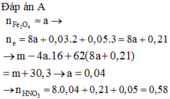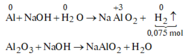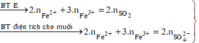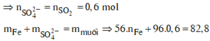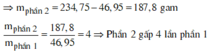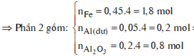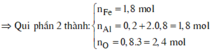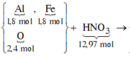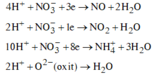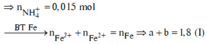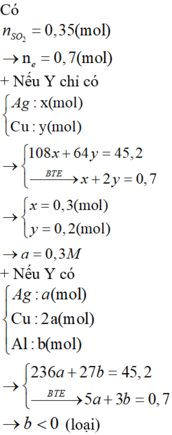câu 1. cho 7,36 gam hỗn hợp X gồm Fe và MgO tác dụng với dung dịch H2SO4 đặc nóng, dư. Sau phản ứng thu được dd Y và 2,016 lít khí SO2 (đktc, sản phẩm khử duy nhất). Tính phần trăm khối lượng từng chất trong hỗn hợp X? (%mFe45,65%, %mMgO54,35%)
câu 2. cho m gam hỗn hợp X gồm Cu và Fe2O3 tác dụng với dd H2SO4 đặc nóng, vừa đủ. Sau phản ứng thu được dd Y và 1,12 lít khí SO2 (đktc, sản phẩm khử duy nhất). Cô cạn dd Y được 20 gam muối kha. Tính giá trị m? (m8)
câu 3. cho 28.08 gam hỗn hợp X gồm Ag...
Đọc tiếp
câu 1. cho 7,36 gam hỗn hợp X gồm Fe và MgO tác dụng với dung dịch H2SO4 đặc nóng, dư. Sau phản ứng thu được dd Y và 2,016 lít khí SO2 (đktc, sản phẩm khử duy nhất). Tính phần trăm khối lượng từng chất trong hỗn hợp X? (%mFe=45,65%, %mMgO=54,35%)
câu 2. cho m gam hỗn hợp X gồm Cu và Fe2O3 tác dụng với dd H2SO4 đặc nóng, vừa đủ. Sau phản ứng thu được dd Y và 1,12 lít khí SO2 (đktc, sản phẩm khử duy nhất). Cô cạn dd Y được 20 gam muối kha. Tính giá trị m? (m=8)
câu 3. cho 28.08 gam hỗn hợp X gồm Ag và FeO tác dụng vừa đủ với 46 gam dd H2SO4 98% (đặc nóng). Sau phản ứng thu được dd Y và có V lít khí SO2 thoát ra (đktc, sản phẩm khử duy nhất). Tính giá trị của V? (V=3.472 lít)
câu 4. cho m gam hỗn hợp X gồm Mg và Al2O3 tác dụng vừa đủ với 31,85 gam dd H2SO4 80% (đặc nóng). Sau phả ứng thu được dd Y và có 0,224 lít H2S thoát ra (đktc, sản phẩm khử duy nhất). Tính nồng độ phần trăm các chất có trong dd Y? (C%MgSO4=12,12%, C%Al2(SO4)3=60,44%)
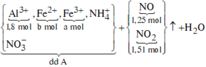
câu 5. cho 16,35 gam hỗn hợp X gồm Al và Fe3O4 tác dụng vừa đủ với dd H2SO4 90% (đặc nóng) Sau phản ứng thu được dd Y và 3,696 lít SO2 (đktc, sản phẩm khử duy nhất). Tính khối lượng ddH2SO4 đặc nóng cần dùng? (mddH2SO4=62,07 gam)