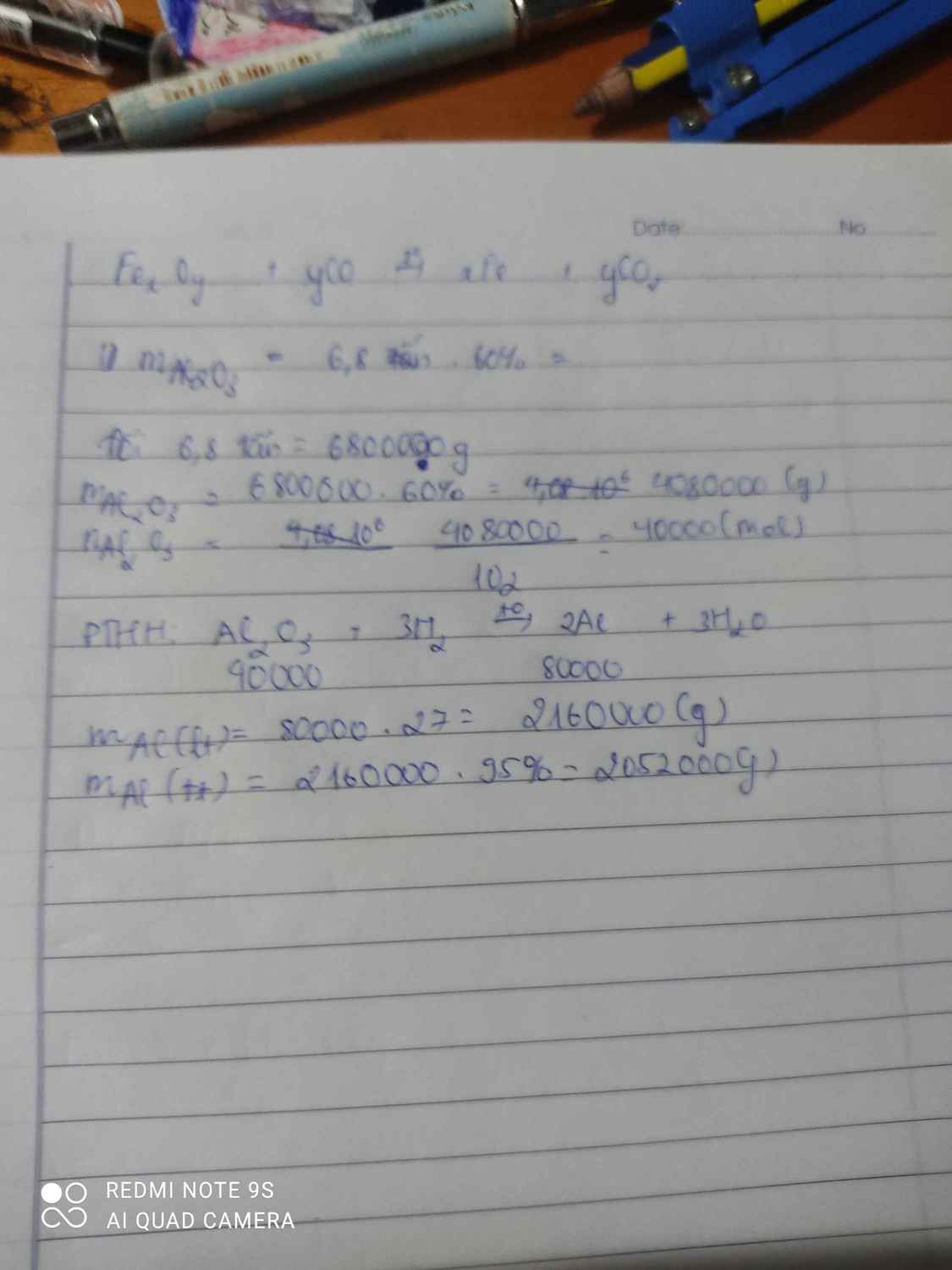có 5 tấn quặng bô xít chứa 55%kim loại nhôm.Người ta tinh luyện lấy nhôm cần qua nhiều bước .Bước 1 loại bớt khối lượng tạp chất trong quặng nhưng cũng có tới 0,2% lượng nhôm trong tạp chất ra ngoài .Bước 2 người ta loại tiếp các tạp chất để dược sản phẩm nhôm chiếm 98% .Hỏi sau bước 2 sản phẩm thu được bao nhiêu kg?

Những câu hỏi liên quan
Trong quặng Bô-xit trung bình có 50% Al2O3. Kim loại luyện được từ Oxit đó có chứa 1,5% tạp chất. Tính lượng Al nguyên chất được điều chế từ nửa tấn quặng Bô-xít. Cho biết rằng để luyện nhân nguyên chất dùng phương trình hóa học luyện Al:
Al2O3 = Al + O2
Nửa tấn=500000g
2Al2O3-->4Al+3O2
Khối lượng Al2O3 nguyên chất trong nửa tấn quặng bô-xít là
500000.50%=250000(g)
Số mol của Al2O3 là
n=m/M=250000/102
=125000/51(mol)
Số mol của Al là
nAl=2nAl2O3=2.125000/51
=250000/51(mol)
Khối lượng của Al là
m=n.M=250000/51.27
=2250000/17( g)
Khối lượng của Al nguyên chất là
2250000/17-
(2250000/17.1.5%)
=2216250/17(g)
Đúng 0
Bình luận (0)
Trong một loại quặng boxit có 50% nhôm oxit. Nhôm luyện từ oxit đó còn chứa 1,5% tạp chất. Tính lượng nhôm thu được khi luyện 0,5 tấn quặng boxit trên. Hiệu suất phản ứng 100%.
Lượng nhôm oxit có trong 0,5 tấn quặng là : 0,5x50/100 = 0,25 tấn = 250kg
Phương trình hoá học điều chế Al :
2 Al 2 O 3 → 4Al + 3 O 2
Khối lượng Al nguyên chất thu được từ 250 kg quặng :
x = 250x4x27/(2x102) = 132,4(kg)
Khối lượng Al lẫn tạp chất: 132,4 x 101,5% = 134,386 (kg).
Đúng 0
Bình luận (0)
1 loại quặng boxit có chứa 60% tạp chất AL2O3. AL luyện từ oxit đó có chứa % tạp chất. tính khối lượng AL thu được khi luyện 6,8 tấn quặng trên. Biết hiệu suất =95%
Giải hộ mình vớiiiiiii
chứa % tạp chất vậy đó là bao nhiêu phần trăm em ơi?
Đúng 1
Bình luận (0)
Bài 3: Một loại quặng chứa 90% oxit Fe 2 O 3 (10% là tạp chất không phải
sắt) Hãy tính:
a) Khối lượng sắt trong 1 tấn quặng.
b) Khối lượng quặng cần để lấy 1 tấn sắt.
a)
$m_{Fe_2O_3} = 1000.90\% = 900(kg)$
$n_{Fe_2O_3} = \dfrac{900}{160} = 5,625(kmol)$
$n_{Fe} = 2n_{Fe_2O_3} = 11,25(kmol)$
$m_{Fe} = 11,25.56 = 630(kg)$
b)
$n_{Fe} = \dfrac{1000}{56}(kmol)$
$n_{Fe_2O_3} = 0,5n_{Fe} = \dfrac{125}{14}(kmol)$
$m_{Fe_2O_3} = \dfrac{125}{14}.160 = \dfrac{10000}{7}(kg)$
$m_{quặng} = \dfrac{10000}{7} : 90\% = 1587,3(kg)$
Đúng 0
Bình luận (0)
Tính khối lượng nhôm nguyên chất điều chế được từ một tấn quặng boxit. Bt trong quặng boxit chứa 50% là nhôm oxit và kim loại luyện từ oxit đó còn chứa 2,5%tạp chất.
Phản ứng xảy ra:
\(2Al_2O_3\underrightarrow{^{đpnc}}4Al+3O_2\)
\(m_{Al2O3}=1000.50\%=500\left(kg\right)\)
\(\Rightarrow n_{Al2O3}=\frac{500}{102}\left(mol\right)\Rightarrow n_{Al}=2n_{Al2O3}=\frac{500}{51}\left(mol\right)\)
\(\Rightarrow m_{Al}=\frac{500}{51}.27=264,7\left(kg\right)\)
\(\Rightarrow m_{\left(nhom.thu.duoc\right)}=\frac{264,7}{97,5\%}=271,5\left(kg\right)\)
Đúng 0
Bình luận (0)
phân hủy 20,4kg quặng boxit thành phần chủ yếu là nhôm oxit Al203 (ngoài ra còn tạp chất khác không bị phân hủy ) thu được 5,4kg nhôm và 4,8kg ooxxi.
a, viết PTHH.
b, tính khối lượng Al203 bị phân hủy.
c, tính % tạp chất trong quặng trên
a) 2Al2O3 --------> 4 Al + 3O2
b) Theo ĐLBTKL, ta có khối lượng của Al2O3 bị phân hủy là:
mAl2O3 = mAl+ mO2
= 5,4+ 4,8= 10,2 (g)
c) % tạp chất trong quặng trên là:
100- ( \(\frac{10,2}{20,4}\). 100)= 50%
Đúng 0
Bình luận (0)
Phân hủy 20,4 kg quặng bôsít thành phần chủ yếu là nhôm ôxít Al203 ( ngoài ra còn tạp chất không bị phân hủy) thu được 5,4 kg nhôm và 4,8 kg ôxi
a, Viết PTHH
b, Tính khối lượng Al203 bị phân hủy
c, Tính % tạp chất trong quặng trên
Theo đlbtkl:
mAl2O3=mAl+mO2
->mAl2O3=5.4+4.8=10.2(kg)
mtạp chất=20.4-10.2=10.2(g)
->% tạp chất không bị phân hủy=50%
Đúng 0
Bình luận (0)
a)PTHH:2Al2O3---->4Al+3O2
b)mAl2O3=Al+O2
=5.4+4.8
=10.2(g)
c)mtạp chất=20,4-10,2
=10,2(g)
%tạp chất=(10,2:20,4)*100%=50%
Đúng 0
Bình luận (0)
a) 2Al2O3 ---> 4Al + 3O2
b) Theo bảo toàn khối lượng, ta có:
mAl2O3 = mAl + mO2
mAl2O3 = 5.4 + 4.8
=> mAl2O3= 10.2g
c) %Al=\(\frac{10.2}{20.4}\cdot100\) =50%
=>%tạp chất=100-50=50%
Chúc em học tốt!!:))0
Đúng 0
Bình luận (0)
Tính lượng nhôm nguyên chất điều chế dc từ 1 tấn quặng boxit . Biết rằng trong quặng boxit chứa 50% là nhôm oxit và kim loại luyện từ oxit đó còn chứa 2,5% tạp chất.
m Al2O3 = 0.5 tấn
2Al2O3 -to-> 4Al + 3O2
204_________108
0.5_________x
x =0.265
mAl thực = 0.265*(100-2.5)/100= 0.258375 tấn
Đúng 0
Bình luận (0)
Từ 1 tấn quặng sắt cromit (có thể viết tắt
Fe
CrO
2
2
người ta điều chế được 216 kg hợp kim ferocrom (hợp kim Fe-Cr) có chứa 65% Cr. Giả sử hiệu suất của quá trình là 90%. Phần trăm khối lượng của của tạp chất trong quặng là A. 33,6%. B. 27,2%. C. 30,2% D. 66,4%.
Đọc tiếp
Từ 1 tấn quặng sắt cromit (có thể viết tắt Fe CrO 2 2 người ta điều chế được 216 kg hợp kim ferocrom (hợp kim Fe-Cr) có chứa 65% Cr. Giả sử hiệu suất của quá trình là 90%. Phần trăm khối lượng của của tạp chất trong quặng là
A. 33,6%.
B. 27,2%.
C. 30,2%
D. 66,4%.