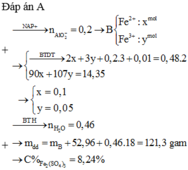cho 0,78 g hỗn hợp dạng bột gồm Al và Fe tác dụng với dung dịch NaOH dù sản phẩm ứng thu được 672ml khí H2 a) viết PTHH b) tính % về khối lượng của Al và Fe

Những câu hỏi liên quan
Cho 15,6 gam hỗn hợp X gồm Al và Fe tác dụng với dung dịch NaOH dư, thu được 6,72 lít khí H2 (đktc). Khối lượng của Fe trong X là A. 5,4 gam B. 5,1 gam C. 10,2 gam D. 2,7 gam
Đọc tiếp
Cho 15,6 gam hỗn hợp X gồm Al và Fe tác dụng với dung dịch NaOH dư, thu được 6,72 lít khí H2 (đktc). Khối lượng của Fe trong X là
A. 5,4 gam
B. 5,1 gam
C. 10,2 gam
D. 2,7 gam
Cho 15,6 gam hỗn hợp X gồm Al và Fe tác dụng với dung dịch NaOH dư, thu được 6,72 lít khí H2 (đktc). Khối lượng của Fe trong X là A. 5,4 gam B. 5,1 gam C. 10,2 gam D. 2,7 gam
Đọc tiếp
Cho 15,6 gam hỗn hợp X gồm Al và Fe tác dụng với dung dịch NaOH dư, thu được 6,72 lít khí H2 (đktc). Khối lượng của Fe trong X là
A. 5,4 gam
B. 5,1 gam
C. 10,2 gam
D. 2,7 gam
Chia 4 g hỗn hợp bột kim loại gồm Al, Fe, Cu thành hai phần đều nhau: - Cho phần (1) tác dụng với lượng dư dung dịch HCl, thu được 560 ml
H
2
. - Cho phần (2) tác dụng với lượng dư dung dịch NaOH, thu được 336 ml
H
2
. Các thể tích khí đo ở đktc. Phần trăm khối lượng của Cu có trong hỗn hợp là A. 13,50%. B. 28,00%. C. 79,25%. D. 58,50%.
Đọc tiếp
Chia 4 g hỗn hợp bột kim loại gồm Al, Fe, Cu thành hai phần đều nhau:
- Cho phần (1) tác dụng với lượng dư dung dịch HCl, thu được 560 ml H 2 .
- Cho phần (2) tác dụng với lượng dư dung dịch NaOH, thu được 336 ml H 2 .
Các thể tích khí đo ở đktc. Phần trăm khối lượng của Cu có trong hỗn hợp là
A. 13,50%.
B. 28,00%.
C. 79,25%.
D. 58,50%.
Hỗn hợp A gồm Al, Al2O3, Fe, Fe3O4, Fe(NO3)2 (trong đó oxi chiếm 36,6% về khối lượng). Hòa tan hoàn toàn 27,8 gam hỗn hợp A trong 100 gam dung dịch H2SO4 47,04% thu được dung dịch B chỉ chứa muối sunfat trung hòa và hỗn hợp khí C gồm 4 khí đều là các sản phẩm khử của N+5. Cho dung dịch B tác dụng với dung dịch NaOH dư thấy có 1,16 mol NaOH phản ứng, sau phản ứng thu được 14,35 gam kết tủa và 0,224 lít khí thoát ra ở đktc. Nồng độ % của muối Fe3+ trong dung dịch B gần nhất với giá trị nào sau đây...
Đọc tiếp
Hỗn hợp A gồm Al, Al2O3, Fe, Fe3O4, Fe(NO3)2 (trong đó oxi chiếm 36,6% về khối lượng). Hòa tan hoàn toàn 27,8 gam hỗn hợp A trong 100 gam dung dịch H2SO4 47,04% thu được dung dịch B chỉ chứa muối sunfat trung hòa và hỗn hợp khí C gồm 4 khí đều là các sản phẩm khử của N+5. Cho dung dịch B tác dụng với dung dịch NaOH dư thấy có 1,16 mol NaOH phản ứng, sau phản ứng thu được 14,35 gam kết tủa và 0,224 lít khí thoát ra ở đktc. Nồng độ % của muối Fe3+ trong dung dịch B gần nhất với giá trị nào sau đây?
A. 14%.
B. 10%.
C. 8%.
D. 15%.
Hỗn hợp A gồm Al, Al2O3, Fe, Fe3O4, Fe(NO3)2 (trong đó oxi chiếm 36,6% về khối lượng). Hòa tan hoàn toàn 27,8 gam hỗn hợp A trong 100 gam dung dịch H2SO4 47,04% thu được dung dịch B chỉ chứa muối sunfat trung hòa và hỗn hợp khí C gồm 4 khí đều là các sản phẩm khử của N+5. Cho dung dịch B tác dụng với dung dịch NaOH dư thấy có 1,16 mol NaOH phản ứng, sau phản ứng thu được 14,35 gam kết tủa và 0,224 lít khí thoát ra ở đktc. Nồng độ % của muối Fe3+ trong dung dịch B gần nhất với kết quả nào sau đây...
Đọc tiếp
Hỗn hợp A gồm Al, Al2O3, Fe, Fe3O4, Fe(NO3)2 (trong đó oxi chiếm 36,6% về khối lượng). Hòa tan hoàn toàn 27,8 gam hỗn hợp A trong 100 gam dung dịch H2SO4 47,04% thu được dung dịch B chỉ chứa muối sunfat trung hòa và hỗn hợp khí C gồm 4 khí đều là các sản phẩm khử của N+5. Cho dung dịch B tác dụng với dung dịch NaOH dư thấy có 1,16 mol NaOH phản ứng, sau phản ứng thu được 14,35 gam kết tủa và 0,224 lít khí thoát ra ở đktc. Nồng độ % của muối Fe3+ trong dung dịch B gần nhất với kết quả nào sau đây?
A. 8%
B. 14%
C. 10%
D. 15%
Hỗn hợp A gồm Al, Al2O3, Fe, Fe3O4, Fe(NO3)2 (trong đó oxi chiếm 36,6% về khối lượng). Hòa tan hoàn toàn 27,8 gam hỗn hợp A trong 100 gam dung dịch H2SO4 47,04% thu được dung dịch B chỉ chứa muối sunfat trung hòa và hỗn hợp khí C gồm 4 khí đều là các sản phẩm khử của N+5. Cho dung dịch B tác dụng với dung dịch NaOH dư thấy có 1,16 mol NaOH phản ứng, sau phản ứng thu được 14,35 gam kết tủa và 0,224 lít khí thoát ra ở đktc. Nồng độ % của muối Fe3+ trong dung dịch B gần nhất với giá trị nào sau đây...
Đọc tiếp
Hỗn hợp A gồm Al, Al2O3, Fe, Fe3O4, Fe(NO3)2 (trong đó oxi chiếm 36,6% về khối lượng). Hòa tan hoàn toàn 27,8 gam hỗn hợp A trong 100 gam dung dịch H2SO4 47,04% thu được dung dịch B chỉ chứa muối sunfat trung hòa và hỗn hợp khí C gồm 4 khí đều là các sản phẩm khử của N+5. Cho dung dịch B tác dụng với dung dịch NaOH dư thấy có 1,16 mol NaOH phản ứng, sau phản ứng thu được 14,35 gam kết tủa và 0,224 lít khí thoát ra ở đktc. Nồng độ % của muối Fe3+ trong dung dịch B gần nhất với giá trị nào sau đây?
A. 14%.
B. 10%.
C. 8%.
D. 15%.
Chọn C.
Khi B tác dụng với NaOH dư thì: n N H 3 =0,01 mol
Dung dịch sau cùng có chứa Na+ (1,16 mol); SO42- (0,48 mol), AlO2-
Dung dịch B chứa Al3+ (0,2 mol), Fe2+ (x mol); Fe3+ (y mol); NH4+ (0,01 mol); SO42- (0,48 mol)
Từ (1), (2) suy ra: x = 0,1; y = 0,05
Khối lượng H2O có trong dung dịch H2SO4 là 52,96 (g) nH2O=0,46 mol (tạo thành)
Khối lượng dung dịch sau phản ứng: mB + (52,96 + 0,46.18) = 121,3 (g)
% m F e 2 S O 4 3 = 8 , 24 m o l
Đúng 0
Bình luận (0)
Hỗn hợp A gồm Al, Al2O3, Fe, Fe3O4, Fe(NO3)2 (trong đó oxi chiếm 36,6% về khối lượng). Hòa tan hoàn toàn 27,8 gam hỗn hợp A trong 100 gam dung dịch H2SO4 47,04% thu được dung dịch B chỉ chứa muối sunfat trung hòa và hỗn hợp khí C gồm 4 khí đều là các sản phẩm khử của N+5. Cho dung dịch B tác dụng với dung dịch NaOH dư thấy có 1,16 mol NaOH phản ứng, sau phản ứng thu được 14,35 gam kết tủa và 0,224 lít khí thoát ra ở đktc. Nồng độ % của muối Fe3+ trong dung dịch B gần nhất với kết quả nào sau đây...
Đọc tiếp
Hỗn hợp A gồm Al, Al2O3, Fe, Fe3O4, Fe(NO3)2 (trong đó oxi chiếm 36,6% về khối lượng). Hòa tan hoàn toàn 27,8 gam hỗn hợp A trong 100 gam dung dịch H2SO4 47,04% thu được dung dịch B chỉ chứa muối sunfat trung hòa và hỗn hợp khí C gồm 4 khí đều là các sản phẩm khử của N+5. Cho dung dịch B tác dụng với dung dịch NaOH dư thấy có 1,16 mol NaOH phản ứng, sau phản ứng thu được 14,35 gam kết tủa và 0,224 lít khí thoát ra ở đktc. Nồng độ % của muối Fe3+ trong dung dịch B gần nhất với kết quả nào sau đây?
A. 8%
B. 14%
C. 10%
D. 15%
Cho 19,3 gam hỗn hợp gồm Al và Fe tác dụng vừa đủ với 200 ml dung dịch gồm HCl 2M và H2SO4 2,25M (loãng) thu được V lít khí H2 (đktc) và dung dịch B.
a) Tính thành phần phần trăm khối lượng của Al và Fe trong hỗn hợp ban đầu.
b) Tính tổng khối lượng muối có trong dung dịch B.
\(n_{Al}=a\left(mol\right)\)
\(n_{Fe}=b\left(mol\right)\)
\(m=27a+56b=19.3\left(g\right)\left(1\right)\)
\(n_{H^+}=0.2\cdot2+0.2\cdot2.25\cdot2=1.3\left(mol\right)\)
\(2Al+6H^+\rightarrow2Al^{3+}+3H_2\)
\(Fe+2H^+\rightarrow Fe^{2+}+H_2\)
\(n_{H^+}=3a+2b=1.3\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.3,b=0.2\)
\(\%Al=\dfrac{0.3\cdot27}{19.3}\cdot100\%=41.96\%\)
\(\%Fe=58.04\%\)
\(b.\)
\(n_{H_2}=\dfrac{1}{2}n_{H^+}=0.65\left(mol\right)\)
Bảo toàn khối lượng :
\(m_{Muối}=19.3+0.4\cdot36.5+0.45\cdot98-0.65\cdot2=76.7\left(g\right)\)
Đúng 4
Bình luận (4)
cho 11 gam hỗn hợp gồm al và fe tác dụng vừa đủ với đ hcl tạo 8,96 lít khí h2 thoát thành ra ở đktc. Viết pthh và tính:
a)tính % về khối lượng các chất ban đầu
b)dẫn toàn bộ khí trên qua 16 gam bột cuo đun nóng đến phản ứng kết thúc. tính cu thu được
a) PTHH: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
a_____________________\(\dfrac{3}{2}\)a (mol)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
b____________________b (mol)
Ta lập HPT: \(\left\{{}\begin{matrix}27a+56b=11\\\dfrac{3}{2}a+b=\dfrac{8,96}{22,4}=0,4\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2\cdot27}{11}\cdot100\%\approx49,09\%\\\%m_{Fe}=50,91\%\end{matrix}\right.\)
b) PTHH: \(CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\\n_{H_2}=\dfrac{3}{2}a+b=0,4\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) H2 còn dư, tính theo CuO
\(\Rightarrow n_{Cu}=0,2\left(mol\right)\) \(\Rightarrow m_{Cu}=0,2\cdot64=12,8\left(g\right)\)
Đúng 3
Bình luận (1)
Gọi n Al = a ( mol ) , n Fe = b ( mol )
Có: n H2 = 0,4 ( mol )
PTHH
2AL + 6HCL ===> 2ALCL3 + 3H2
a--------------------------------------a
Fe + 2HCl ====> FeCL2 + H2
b------------------------------------b
Ta có hpt:
\(\left\{{}\begin{matrix}27a+56b=11\\1,5a+b=0,4\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\)
=> m AL = 5,4 ( g ) ; m Fe = 5,6 ( g )
b) Có : n CuO = 0,2 ( mol )
PTHH:
CuO + H2 ====> Cu +H2O
0,2----0,2-----------0,2
theo pthh: n Cu = 0,2 ( mol ) => m Cu = 12,8 ( g )
Đúng 1
Bình luận (1)
\(n_{H2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Pt : \(2Al+6HCl\rightarrow2AlCl_3+3H_2|\)
2 6 2 3
a 1,5a
\(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
b 1b
a) Gọi a là số mol của Al
b là số mol của Fe
\(m_{Al}+m_{Fe}=11\left(g\right)\)
⇒ \(n_{Al}.M_{Al}+n_{Fe}.M_{Fe}=11g\)
⇒ 27a + 56b = 11g (1)
Theo phương trình : 1,5a +1b = 0,4(2)
Từ (1),(2), ta có hệ phương trình :
27a + 56b = 11
1,5a + 1b = 0,4
⇒ \(\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\)
\(m_{Al}=0,2.27=5,4\left(g\right)\)
\(m_{Fe}=0,1.56=5,6\left(g\right)\)
0/0Al = \(\dfrac{5,4.100}{11}=49,09\)0/0
0/0Fe = \(\dfrac{5,6.100}{11}=50,91\)0/0
b) Pt : \(H_2+CuO\rightarrow\left(t_o\right)Cu+H_2O|\)
1 1 1 1
0,4 0,4
\(n_{Cu}=\dfrac{0,4.1}{1}=0,4\left(mol\right)\)
⇒ \(m_{Cu}=0,4.64=25,6\left(g\right)\)
Chúc bạn học tốt
Đúng 1
Bình luận (2)