có bao nhiêu nguyên tử trong 18g nước

Những câu hỏi liên quan
Bài 1: (Lấy N= 6.1023). Có Bao Nhiêu Nguyên Tử Chứa Trong:
a. 2 mol nhôm
b. 0,1 mol lưu huỳnh
c. 18g nước
d. 6,3g axit nitric
Bài 2 : Trong 20g NaOH có bao nhiêu mol NaOH? Bao nhiêu phân tử NaOH ? Tính khối lượng nước trong đó có số phân tử bằng số ph.tử NaOH ?
Bài 1:
a) Số nguyên tử Al: 2. 6.1023=12.1023 (nguyên tử)
b) Số nguyên tử S: 0,1.6.1023= 6.1022 (nguyên tử)
c) nH2O=18/18=1(mol)
=> Tổng số mol nguyên tử: 2.1+1=3(mol)
Số nguyên tử trong 18 gam H2O: 3.6.1023=18.1023 (nguyên tử)
d) nHNO3= 6,3/63=0,1(mol)
Số mol nguyên tử trong 6,3 gam HNO3: 0,1.1+0,1.1+0,1.3=0,5(mol)
Số nguyên tử trong 6,3 gam HNO3: 0,5.6.1023=3.1023 (nguyên tử)
Đúng 4
Bình luận (0)
Bài 2:
nNaOH=20/40= 0,5(mol)
Số phân tử NaOH: 0,5.6.1023=3.1023 (phân tử)
Số phân tử H2O= Số phân tử NaOH
<=> nH2O=nNaOH=0,5(mol)
=> mH2O=0,5.18=9(g)
Đúng 4
Bình luận (0)
Cho biết số phân tử nước có trong 18g nước.Từ công thức hóa học của nước H2O cho biết số nguyên tử O,H có trong 18g nước đó.
tính số nguyên tử O có trong 18g CO2
Anh đang ngoài đường không gõ latex tiện. Em thông cảm nha!
nCO2= 18/44= 9/22 (mol)
nO= 2. nCO2= 2. 9/22= 9/11(mol)
Số nguyên tử O trong 18g CO2:
9/11 x 6,023 x 1023= 4,928 x 1023 (nguyên tử)
Đúng 4
Bình luận (3)
$\text{nCO2= 18/44= 9/22 (mol)}$
$\text{nO= 2. nCO2= 2. 9/22= 9/11(mol)}$
$\text{Số nguyên tử O trong 18g CO2:}$
$\text{9/11 x 6,023 x 1023= 4,928 x 1023 (nguyên tử)}$
Đúng 1
Bình luận (0)
tính số nguyên tử hoặc phân tử có trong;
a) 32g S
b) 18g H2O
c) 27g Al
\(a.n_S=\dfrac{32}{32}=1\left(mol\right)\\ \Rightarrow A=1.6,02.10^{23}=6,02.10^{23}\left(nguyêntử\right)\\ b.n_{H_2O}=\dfrac{18}{18}=1\left(mol\right)\\ \Rightarrow A=1.6,02.10^{23}=6,02.10^{23}\left(phântử\right)\\ c.n_{Al}=\dfrac{27}{27}=1\left(mol\right)\\ \Rightarrow A=1.6,02.10^{23}=6,02.10^{23}\left(nguyêntử\right)\)
Đúng 2
Bình luận (0)
a) có một nguyên tử lưu huỳnh nặng: 32x0,16605x10^-23=5,3136x10^-23 (gam)
vậy trong 32g S có: 32:5,3136x10^-23=6,02x10^-23( nguyên tử)
b) Một phân tử nước nặng: 16x0,16605x10^-23+2x0,16605x10^-23=2,9889 ( gam)
vậy trong 18 g h2o có: 18: 2,9889x10^-23=6,02x10^-23( phân tử)
c) một nguyên tử nhôm nặng: 27x0,16605x10^-23=4,48335x10^-23 ( gam)
vậy trong 27g Al có: 27: 4,48335x10^-23=6,02x10^-23( gam)
chúc bạn học tốt!
Đúng 0
Bình luận (0)
33. 1 lít nước có bao nhiêu mol nước, bao nhiêu phân tử nước, bao nhiêu nguyên tử hiđro, bao nhiêu nguyên tử oxi? Biết khối lượng riêng của nước là 1 g/ml
Hidro có nguyên tử khối là 1,008. Hỏi có bao nhiêu nguyên tử của đồng vị trong 1ml nước (cho rằng trong nước chỉ có đồng vị và )? (Cho khối lượng riêng của nước là 1g/ml)
Đọc tiếp
Hidro có nguyên tử khối là 1,008. Hỏi có bao nhiêu nguyên tử của đồng vị 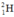 trong 1ml nước (cho rằng trong nước chỉ có đồng vị
trong 1ml nước (cho rằng trong nước chỉ có đồng vị 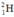 và
và 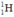 )? (Cho khối lượng riêng của nước là 1g/ml)
)? (Cho khối lượng riêng của nước là 1g/ml)
Gọi % đồng vị 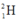 là a:
là a:
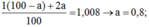

m của 1ml H2O: 1 gam
⇒ MH2O = 2. 1,008 + 16 = 18,016u
Khối lượng của 1 mol H2O là 18,016g.
Khối lượng của 1 mol H2O là 18,016g.
Số mol H2O =  mol
mol
⇒ số mol nguyên tử H = 2.nH2O = 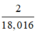 mol
mol
1 mol nguyên tử chứa 6,022.1023 nguyên tử
⇒ Số nguyên tử H trong 1ml H2O = 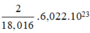
⇒ Số nguyên tử 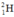 trong 1ml H2O =
trong 1ml H2O = 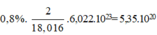 (nguyên tử)
(nguyên tử)
Đúng 1
Bình luận (0)
Hidro trong nước có khối lượng nguyên tử trung bình là 1008. Hỏi có bao nhiêu nguyên tử đồng vị?
Hiđro có nguyên tử khối là 1,008. Hỏi có bao nhiêu nguyên tử của đồng vị
H
1
2
trong 1ml nước (cho rằng trong nước chỉ có hai đồng vị
H
1
và
H
2
). Biết rằng
d
H
2
O
1...
Đọc tiếp
Hiđro có nguyên tử khối là 1,008. Hỏi có bao nhiêu nguyên tử của đồng vị H 1 2 trong 1ml nước (cho rằng trong nước chỉ có hai đồng vị H 1 và H 2 ). Biết rằng d H 2 O = 1 g / m l và nguyên tử khối của oxi là 16.
A. 3,01.1023.
B. 6,02.1023
C. 5,35.1020
D. 2,67.1020
Đáp án C
Gọi x là phần trăm nguyên tử của đồng vị H 1 2 ta có:
2 x + 1 ( 1 - x ) = 1 , 008 ⇒ x = 0 , 008
d = 1 g / m l ⇒ m H 2 O = 1 ⇒ n H 2 O = 1 18 ⇒ n H = 1 9 m o l
1 mol H chứa 0,008.6,02.1023 đồng vị H 1 2
⇒ 1 9 mol chứa 0 , 008 . 6 , 02 . 10 23 9 = 5 , 35 . 10 20
Đúng 0
Bình luận (0)
Hiđro điều chế từ nước nguyên chất có khối lượng nguyên tử trung bình là 1,008. Hỏi có bao nhiêu nguyên tử của đồng vị 2H trong 9ml nước? (Trong nước, H chủ yếu là 2 đồng vị là 1H và 2H ).
\(\%^1H=a;\%^2H=100\%-a\left(a>0\right)\\\overline{NTK}_H=1,008\\ \Leftrightarrow\dfrac{1.a+2.\left(100\%-a\right)}{100\%}=1,008\\ \Leftrightarrow a=99,2\%\\ \Rightarrow^1H=99,2\%;\%^2H=0,8\%\)
Số nguyên tử của đồng vị 2H có trong 9ml nước là:
\(\dfrac{9.1}{18}.6.10^{23}.\dfrac{2}{18}.0,8\%\approx2,667.10^{20}\left(nguyên.tử\right)\)
Đúng 1
Bình luận (0)
Hiđro điều chế từ nước nguyên chất có khối lượng nguyên tử trung bình là 1,008. Hỏi có bao nhiêu nguyên tử của đồng vị 1H trong 45 ml nước? (Trong nước, chủ yếu tồn tại 2 đồng vị là 1H và 2H).


















